User:Cristiane Custodio Ross Matheus/Sandbox 1
From Proteopedia
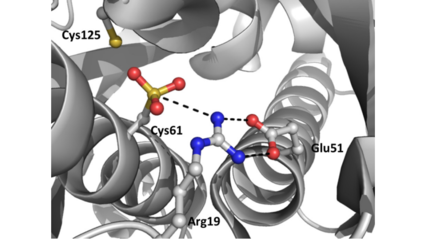
IntroductionOhr é uma enzima antioxidante dependente de tiol que pertence à família das Ohr/OsmC, presente em bactérias e fungos, e que tem por função a proteção destes microrganismos ao estresse oxidativo. É evidente, portanto, que essa proteína tem um papel central na defesa bacteriana contra oxidantes advindos da reação do hospedeiro à infecção. Com o avanço dos estudos a respeito desse composto descobriu-se que as Ohr são os atores essenciais na decomposição de hidroperóxidos de ácidos graxos e peroxinitrito, ou seja, possui esses compostos como seu principal substrato, não apresentando muita eficiência na decomposição de outros tipos de oxidantes. Dentro desse contexto é importante salientar que apesar de semelhantes às peroxirredoxinas, as Ohr não são vistas como tal. As peroxirredoxinas nada mais são que proteínas que também possuem ação antioxidante mas que tem uma estrutura tanto primária quanto terciária, bem diferente das enzimas Ohr. Um outro ponto importante a se levantar é a relevância dos estudos das Ohr para a criação de novos fármacos, visto que é uma enzima cuja estrutura é característica apenas a bactérias e fungos, não apresentando estrutura similar em animais e plantas. Alguns exemplos de bactérias patogênicas que expressam proteínas Ohr são Pseudomonas aeruginosa, Vibrio cholerae e Xylella fastidiosa. É importante salientar que essa proteína varia de acordo com o microrganismo estudado, tendo diferenças em sua regulação e expressão, sendo o exemplo usado para essa página a proteína Ohr de Xylella fastidiosa Organic Hydroperoxide Resistance Protein from Xylella fastidiosa (Ohr)Xylella fastidiosa é uma bactéria gram negativa, colonizadora restrita do xilema de plantas, conhecida por causar doenças em diversas monocotiledôneas e dicotiledôneas de grande importância econômica. Abordando a relação patógeno-hospedeiro foi possível observar que a planta libera espécies reativas de oxigênios que funcionam como agentes microbicidas. Dentre as ROS produzidas se encontram os hidroperóxidos de ácidos graxos, gerados a partir de uma reação de oxidação catalisada pelas enzimas lipoxigenases. Para se defender desse ataque oxidativo a Xylella produz a enzima Ohr. Dentro desse tópico foi observado que em uma situação de aumento do estresse não há aumento da quantidade de enzima, concluindo-se que nessa bactéria não há um mecanismo regulatório como para a maioria dos MO que possuem o gene da Ohr. Ohr gene regulationOhrR é um fator transcricional caracterizado por ser uma proteína repressora e o principal fator regulatório do gene Ohr na maioria dos microrganismos. Essa proteína se encontra sobre o promotor do gene da Ohr e tem a sua estrutura alterada quando oxidada, ao entrar em contato com hidroperóxidos de ácidos graxos e peroxinitritos. Com a mudança de conformação gerada pela oxidação da OhrR ocorre o seu desprendimento do promotor do gene, fazendo com que o mesmo se torne mais acessível a RNA polimerase, ocorrendo por consequência uma superexpressão do gene da Ohr. Além da OhrR também foram encontrados em alguns microrganismos meios regulatórios distintos para o gene da Ohr. Um exemplo é a regulação positiva pelo fator sigma alternativo, presente em alguns microrganismos Structural featuresOhr apresenta características estruturais e bioquímicas distintas quando comparada a peroxidases baseadas em Cys de mamíferos. Essa proteína apresenta estrutura semelhante à de um barril formada por um homodímero firmemente dobrado, no qual duas folhas β, de seis fitas, envolvem duas α-hélices centrais. Há dois locais ativos na enzima que se encontram localizados na interface do dímero em lados opostos da proteína. A arquitetura do sítio catalítico de Ohr é composta por duas cisteínas, a peroxidática e a de resolução. A Cisteína peroxidática, localizada em uma das α-hélices centrais, tem por função a reação direta com hidroperóxidos, formando um ácido sulfênico. Este por sua vez se condensa com a Cisteína de resolução para formar uma ligação dissulfeto intramolecular. Além dos dois aminoácidos de Cys há também a presença de uma Arginina catalítica e um Glutamato que tem extrema importância na atividade da enzima Ohr, uma vez que ajudam a estabilizar a Cys em seu estado de tiolato através de interações polares, aumentando sua nucleofilicidade. O grupo carboxílico do glutamato catalítico orienta o grupo guanidínio da Arginina em direção a Cisteína, em uma configuração que parece ser ideal para a redução de hidroperóxidos orgânicos. Esse processo de estabilização descrito é o chamado estado fechado da tríade catalítica. No estado aberto ocorre o rompimento das interações e consequente mudança conformacional que acaba expondo o resíduo ao solvente, sendo esse último estado o mais propício para a redução da Ohr 3D structures of OhrOrganic hydroperoxide resistance protein Additional detailsOxymyoglobin for myoglobin complex with O2
Myoglobin-Physeter-catodon-structure (Spanish) 3D Structures of Myoglobin
| ||||||||||||