מידע כללי על החלבון
אקטינים הם חלבונים שמורים מאוד המעורבים בסוגים שונים של תנועתיות תאים ומתבטאים בכל מקום בכל התאים האוקריוטיים..אקטין הוא המונומר של שני סוגי סיבים: מיקרופילמנטים שהם חלק משלד התא וסיבים דקים שהם חלק מהשרירים. שלוש איזופורמות (צורות) של אקטין מזוהות אצל חולייתנים: α)Aa) או (G-actin) המצוי ברקמת השריר ומהווה מרכיב מרכזי במנגנון ההתכווצות, אקטין β)Ab) ו-γ)Ag) הם מרכיבים של שלד התא ומתווכים של תנועתיות פנימית של תאים. F-actin קושר Aa ל-ATP.
אקטין משתתף בהתכווצות השרירים, תנועתיות התא, חלוקת תאים וציטוקינזיס. אקטין הקשור למיוזין אחראי לרוב תנועות התאים. אקטין הוא אחד החלבונים הנפוצים ביותר בתאים איקריוטיים וריכוזו הוא סביב ה-100 מיקרומולר. בנוסף, הוא אחד החלבונים שהשתמרו ביותר מבחינה אבולוציונית. לדוגמה, ההבדל ברצף החלבון בין אצה לאדם הוא לא יותר מ-5%.
<p dir='rtl'> לסיבי האקטין מספר תפקידי מפתח בתא:
* תמיכה מכנית בקרום התא.
* קביעת צורת התא.
* תנועת התא.
* השתתפות בסוגים מסוימים של צומתי תאים.
* מתן אפשרות להעברת ציטופלזמה מתא לתא.
* כיווץ התא בזמן חלוקת התא.
* בתאי השריר, השתתפות בכיווץ התא יחד עם מולקולות מיוזין.
לפרטים נוספים ראה:
*F-actin
*אקטין מונומרי שלא ניתן לפלמר
*2 קונפורמציות של אקטין Ag: 1hlu 2btf
היסטוריה
האקטין נצפה לראשונה במיקרוסקופ ב-1887 על ידי ו"ד הליבורטון, שבודד מתא שריר חלבון שגרם לקרישת תמצית מיוזין. למרות זאת, הליבורטון לא הצליח לאפיין יותר את החלבון שראה וגילוי האקטין יוחס לברונו פ' שטאוב, ביוכימאי צעיר שעבד במעבדתו של אלברט סנט-דיאורד במכון לכימיה רפואית באוניברסיטת סגד שבהונגריה. ב-1942 פיתח שטאוב טכניקה חדשנית לבידוד חלבון מהשריר שאפשרה לו לבודד כמויות גדולות יחסית של אקטין טהור, בשיטה הדומה לזו שמשתמשים בה כיום לבידוד האקטין.
מחלות קשורות
מחלות
מוטציות ב-a-actin הנמצאות בשרירים מחוספסים בשלד עלולות לגרום למיאופתיה. מוטציות ב-a-actin הנמצאות בשרירים חלקים עלולות לגרום למפרצת של אבי העורקים החזה. מוטציות ב-a-actin הנמצאות בשרירי הלב עלולות לגרום לתפקוד לקוי של הלב.
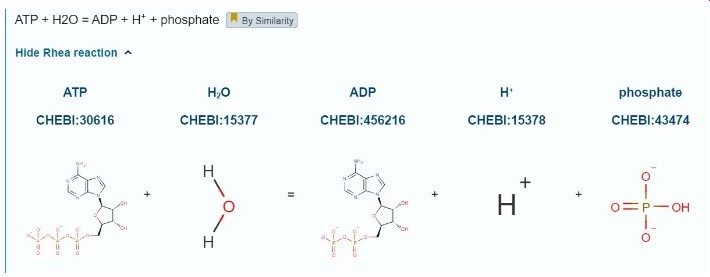
:הפעילות הקטליטית של החלבון - מתוארת בתמונה
:מיקום סיבי האקטין בתוך התא
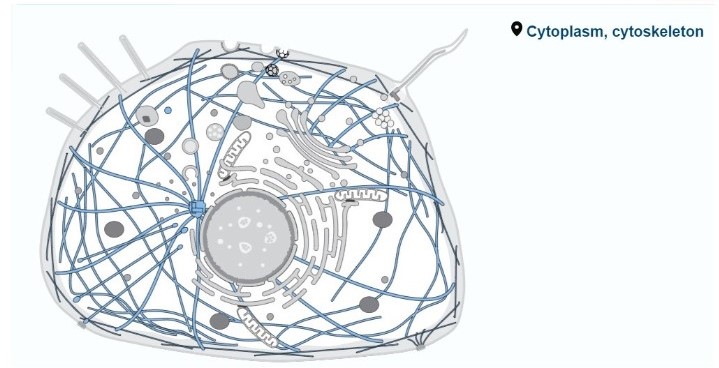
שלד התא הוא מבנה חוטי תלת מימדי דינמי בציטופלזמה. תפקידיו כוללים שמירה על צורת התא, תנועת תאים (באאוקריוטים), תנועת התא וארגון אברונים או מבנים דמויי אברונים בתוך התא. שלד התא כולל מיקרופילמנטים (חלבונים דמויי אקטין), מיקרוטובולים (חלבונים דמויי טובולין), חוטי הביניים (בעיקר באוקריוטים) וחלבוני MinD-ParA, הנראים כייחודיים לפרוקריוטים.
מבנה החלבון ותפקודו
אנזים הליזוזים ממקור ביצי העופות נקרא ליזוזים C (זהו האנזים המוצג בערך). אנזים זה הוא אנזים קטן יחסית ומורכב משרשרת אחת , אשר מונה 129 . הליזוזים, כמו כל חלבון, בנוי מקצות . ניתן להבחין בקצוות אלו בעזרת השינויים בצבעים לאורך החלבון. מצבע אדום בקצה C טרמינלי ,דרך צבעי הקשת ועד צבע כחול בקצה ה-N טרמינלי. המבנה של הליזוזים מורכב מחמישה אזורים של ( בוורוד) וחמישה אזורים המרכיבים את (בכחול). שאר השרשרת כוללת פניות וסלילים אקראיים הנראים באפור. המבנים השניוניים האלו תורמים למבנה המרחבי של האנזים כולו. מבנה מרחבי זה מאפשר את הקישור לסובסטרט.
אופיים של שיירי החומצות האמינו בחלבון קובע את רמת הידרופוביות או ההידרופיליות של אזורים שונים בליזוזים. קיפולו של החלבון מושפע ממיקומם של אזורים אלו וקובע את המבנה השלישוני. האזורים ההידרופוביים מופיעים באפור ואילו האזורים ההידרופיליים בסגול. ניתן להבחין בכך שאזורים עם שיירים הידרופוביים נוטים להיות ממוקמים בתוך ליבת המולקולה ואילו אזורים עם שיירים הידרופיליים פונים בעיקר לצד החיצוני של המולקולה, השוהה בסביבה מימית הידרופילית.
הינם קשרים חיוניים לייצובו של כל חלבון. במודל המוצג ניתן להבחין בקשרים אלו, המודגשים בצבע שחור, ותורמים לייצוב המבנה המרחבי (התלת ממדי) של אנזים הליזוזים. קשרים נוספים שניתן לזהות בחלבון הליזוזים הם קשרים דיסולפידים (קשרי גופרית) בין כל שתי חומצות אמיניות ציסטאין. בליזוזים קיימים ארבעה המודגשים בצבע צהוב (העיגולים השחורים מייצגים את אטום הגופרית בציסטאין). גם קשרים אלו נועדו לייצוב במבנה המרחבי של המולקולה וממוקמים בין: Cys 6 ל- Cys 127, בין Cys 30 ל- Cys 115, בין Cys 64 ל- Cys 80 ובין Cys 76 ל-Cys 94. חשיבותם של קשרים אלו למבנה המרחבי ולתפקוד המולקולה באה לידי ביטוי בשימור הקשרים בכל מולקולות הליזוזים בקבוצות אורגניזמים שונות.
שימור אזוריים במולקולה, לאורך האבולוציה מעיד, כאמור, על חשיבותם למבנה המרחבי ולפעילות אנזים הליזוזים. אזורים אלו כוללים בין היתר, את החומצות האמיניות המעורבות ביצירת הקשרים הדיסולפידים וכן את החומצות האמיניות אשר ממוקמות באתר הפעיל (ראה בהמשך) של הליזוזים. ניתן להבחין באזורים השמורים יותר לעומת השמורים פחות על פי סקלת צבעים הנעה מצבע התכלת לצבע הסגול.
האתר הפעיל ומכניזם הפעולה של הליזוזים
הידרוליזה של הקשר בין NAM ל-NAG מתרחשת באתר הפעיל של הליזוזים, שכולל את החומצה הגלוטמית בעמדה 35 (Glu 35) ואת החומצה האספרטית בעמדה 52 (Asp 52). מיקומים אלו שמורים מאוד בליזוזים של אורגניזמים שונים. Glu 35 תורמת פרוטון לקשר הגליקוזידי, כך נחתך הקשר C-O בסובסטרט ואילו Asp 52 משתתפת בהתקפה נוקלאופילית, בעזרת מולקולת מים, לצורך ניתוק האנזים וקבלת הסובסטרט.[1] (המנגנון מודגם באיור 5)
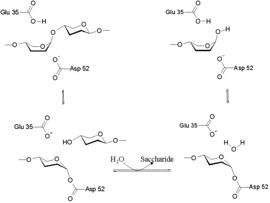
איור 5 - מכניזם הפעולה של ליזוזים
של הליזוזים נראה כמרווח בין Glu 35 (מודגשת ) ל- Asp 52 (מודגשת ). בחלל שנוצר מתמקם הסובסטרט - השרשרת הפוליסכרידית. למעשה, מולקולת הסובסטרט מונה 6 פחמניים. כלומר, מולקולת פוליסכריד בעל 6 טבעות סוכריות שמסודרות בצורת NAM-NAG. החיתוך נעשה בין הסוכר הרביעי לחמישי. נראה ליזוזים מחלבון ביצת תרנגול, ביחד עם הסובסטרט שלו – שרשרת 6 פחמנית. סוכרי השרשרת מסומנים באותיות A-F ומיוצגים על ידי מקלות וכדורים. (חשוב לציין שמודל השרשת ה-6 פחמנית כולל רק יחידות NAG ונבנה באופן מלאכותי .)
העיכוב של פעולת הליזוזים יכול להיעשות על ידי מולקולת "מעכב" שבנויה משרשרת סוכרית קטנה יותר בעלת 3 סוכרי NAG. מולקולת מסוגלת להיקשר לאתר הפעיל וליצור קומפלקס של מעכב-אנזים. המעכב, שמיוצג במודל של מקלות וכדורים, בולט מתוך האתר הפעיל של הליזוזים ומהווה מעכב תחרותי לסובסטרט. מולקולת המעכב, קטנה יותר מהסובסטרט ומתחרה איתו על האתר הפעיל. למרות שמולקולת המעכב נקשרת לאתר הפעיל, לא מתאפשר הזירוז של פירוקו. הסיבה נעוצה בכך שהמעכב בנוי מאתרים A-C, אך לא מכיל אתרים E ו-D שבהם נעשה החיתוך ההידרוליטי על ידי Glu 35 ו- Asp 52. ניתן לעבור בין מודל למודל לצורך הבנת מיקומם של הסובסטרט והמעכב באתר הפעיל של הליזוזים.
דף עבודה לתלמיד
דף עבודה לתלמיד
קישורים נוספים
מקורות מידע
- ↑ Grisham CM, Garrett RH (2007). "Chapter 14: Mechanism of enzyme action". Biochemistry. Australia: Thomson Brooks/Cole. pp. 467–9. ISBN 0-495-11912-1.