Alpha toxin from Clostridium
From Proteopedia
Contents |
רעלן אלפא של חיידק כלוסטרידיום
|
רעלן אלפא הוא אנזים הבנוי כפוליפפטיד עם פעילות פוספוליפאז C. הוא פועל על ידי ביקוע פוספוליפידים, במיוחד פוספטידילכולין, שהוא מרכיב עיקרי של ממברנות התא. פעילות אנזימטית זו משבשת את שלמות ממברנות התא, מה שמוביל למוות תאים ולנזק לרקמות. רעלן אלפא הוא רעלן מרכזי במספר מחלות הנגרמות על ידי חיידקי הכלוסטרידיום וסוגים מסוימים של הרעלת מזון. בנוסף רעלן אלפא יכול גם לווסת את התגובה החיסונית של המארח. הוכח שהוא מעורר דלקת וסערת ציטוקינים, שיכולים לתרום עוד יותר לנזק לרקמות ולהתקדמות המחלה. רעלן אלפא מכוון בעיקר לתאי אנדותל המצפים את כלי הדם, כמו גם סוגי תאים שונים בתוך רקמות מושפעות. ההשפעות שלו מובילות לשיבוש שלמות כלי הדם, נמק רקמות ושחרור מתווכים דלקתיים.
השלכות אבחנתיות וטיפוליות: זיהוי של רעלן אלפא או פעילותו בדגימות קליניות יכול לסייע באבחון של זיהומי כלוסטרידיום. בנוסף, אסטרטגיות שמטרתן לנטרל או לעכב את פעילות רעלן אלפא מייצגות גישות טיפוליות פוטנציאליות לטיפול במחלות הקשורות לחיידקים אלה.
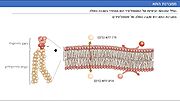
מנגנון פעילות הרעלן: בתחילה רעלן אלפא נקשר לממברנה החיצונית של התא המאחסן[1]. הקשירה מתבצעת ל"ראשים" ההידרופיליים של הפוספוליפידים הבונים את קרום התא
. הרעלן נקשר בקצה ה-C טרמינלי. לאחר מכן, הרעלן עובר תהליך של אוליגומריזציה (שינוי המבנה המרחבי של הרעלן – יפורט בהמשך). בעקבות זאת רעלן מצליח לפרק את הפוספוליפידים (פעילות פוספוליפאז C) וחודר לתוך התא על ידי יצירת נקבוביות שחודרות את הקרום. החדירה של הרעלן משבשת את שלמות קרום התא, מה שמוביל לחוסר איזון מומסים בתא ובעקבות כך למוות התא. המחלה נגרמת בעקבות מוות של תאים רבים והיווצרות אפקט ציטוקיני (משיכה של גורמי דלקת לאזור) ונמק הרקמה.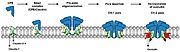
חיידקי הכלוסטרידיום הם חיידקים אנאירוביים, ואינם יכולים לגדול בנוכחות חמצן בכלל. חיידקים אלה מתקיימים בדרך כלל באדמה ומערכת העיכול של בני האדם ובעלי החיים. במצבי עקה חיידקים אלה יוצרים נבגים, אשר מאפשרים להם לשרוד בתנאים קשים ותורמים לפתוגניות שלהם. חיידקי הכלוסטרידיום יכולים לנצל מגוון רחב של חומרים להפקת אנרגיה. עובדה זו תורמת ליכולתם ליישב נישות אקולוגיות שונות.
משפחת הכלוסטרידיום היא מגוונת וכוללת חיידקים לא מזיקים וחיידקים פתוגנים. החיידקים הפתוגניים אחראים על מחלות שונות בבני האדם ובעלי חיים, וביניהן שלשולים, פגיעה ברקמות ואפילו למוות. חיידקים אחרים מנוצלים בתעשייה ובביוטכנולוגיה לייצור מזונות ומשקאות מותססים שונים, ואפילו לייצור דלק ביולוגי באמצעות תהליכי תסיסה.
מבנה הרעלן
רעלן אלפא הוא מולקולת חלבון עם משקל מולקולרי של כ-43 kDa. הוא מורכב משרשרת פוליפפטידית אחת מקופלת למבנה כדורי. החלבון קיים בדרך כלל כמונומר בצורתו הלא פעילה. רעלן אלפא מורכב ממספר אזורים נפרדים, שלכל אחד מהם פונקציות ספציפיות[3]:
מאפיינים מבניים
רעלן אלפא מכיל סלילי אלפא וגדילי בטא המסודרים במבנה שלישוני קומפקטי. החלבון עובר שינויים במבנה המרחבי עם הקישור לממברנות התא, הנחוצים לפעילות האנזימטית שלו ולפונקציות משבשות הממברנה של התא.
תחום ה-N טרמינרלי
תחום זה מכיל את הפעילות האנזימטית של הרעלן. אזור זה פועל כפוספוליפאז, המזרז את ההידרוליזה (חלוקת מולקולה לשני חלקים על ידי מעורבות של מולקולת מים) של פוספטידילכולין בממברנות התא. בתוך התחום הN - טרמינלי, ישנם שיירים של חומצות אמינו ספציפיות היוצרות את האתר הפעיל האחראי על פעילות הפוספוליפאז. שיירים אלה חיוניים לזירוז ההידרוליזה של פוספטידילכולין.
שיירים קטליטיים: רצף ה-N-טרמינלי מכיל בדרך כלל שיירים של חומצות אמינו הפועלות כשיירים קטליטיים (זרזים), המשתתפים ישירות בתגובת ההידרוליזה. שיירים אלה עשויים לכלול חומצות אמינו עם שרשראות צד נוקלאופיליות, כגון סרין, ציסטאין או היסטידין.
אתר קשירת המצע: רצף ה-N-טרמינלי מכיל אזורים היוצרים את אתר הקישור של המצע, מה שמאפשר לאנזים ליצור אינטראקציה עם פוספוליפידים. אזורים אלה כוללים בדרך כלל שיירי חומצות אמינו המעורבות באינטראקציות ספציפיות עם קבוצות הראש הקוטביות או זנבות הידרופוביים של פוספוליפידים. קשרי מימן, אינטראקציות אלקטרוסטטיות ואינטראקציות הידרופוביות כולם תורמים לספציפיות הקישור של המצע.
אתרי קשירת קו-פקטור: חלק מהפוספוליפאזים דורשים קו-פקטורים, כגון יוני מתכת או מולקולות שומנים, לפעילות קטליטית אופטימלית. הרצף ה-N-טרמינלי עשוי להכיל אתרי קישור לקופקטורים אלה, מה שמאפשר להם לווסת את פעילות האנזים ואת סוג המצע.
אזורים שמורים: פוספוליפאזות מכילות לרוב אזורים שמורים בתוך הרצפים ה-N-טרמינליים שלהם האופייניים למשפחת הרעלנים וחיידקי הכלוסטרידיום. אזורים אלה עשויים לכלול מוטיבים של רצף המעורבים בקטליזה, קשירת מצע או יציבות מבנית.
תחום ה-C טרמינלי
אזור זה אחראי על קשירת ממברנה ויצירת נקבוביות. הוא מקיים אינטראקציה עם הפוספוליפידים של ממברנת התא, ומקל על החדרת התחום האנזימטי N-טרמינלי לתוך הממברנה.
מצב אוליגומרי
בעוד רעלן אלפא הוא בעיקרו מונומרי בצורתו הלא פעילה, הוא יכול לעבור אוליגומריזציה לאחר היצמדות לממברנות התא. אוליגומריזציה כרוכה בהרכבה של מולקולות רעלנים מרובות לקומפלקסים גדולים יותר, ההכרחיים לייצור נקבוביות בשכבת הפוספוליפידים של קרום התא, מה שמוביל להפרעה של הממברנה ולמוות תאים. (בערך זה מוצג המצב המונומרי)[4].
רעלן אלפא נקשר בתחילה לפני השטח של התא, כגון תאי אנדותל או תאי מטרה אחרים. קשירה זו מתאפשרת על ידי אינטראקציות בין אזורים ספציפיים של הרעלן, במיוחד בין תחום C טרמינלי לבין פוספוליפידים בממברנת התא. לאחר קשירה ראשונית, אלפא טוקסין עובר אוליגומריזציה, הכוללת הרכבה של מולקולות רעלנים מרובות לקומפלקסים גדולים יותר. אוליגומריזציה מתרחשת בדרך כלל באמצעות אינטראקציות חלבון-חלבון ספציפיות בין מולקולות רעלן בודדות, מה שמוביל ליצירת מבנים אוליגומריים יציבים. האוליגומריזציה של רעלן אלפא חיונית לפעילות הרעלנית שלו ומהווה שלב קריטי במנגנון שבאמצעותו הרעלן משבש את ממברנות התא המאכסן וגורם למוות של תאים.
השיירים הספציפיים המעורבים ביצירת קשרים ליצירת אוליגומרים של טוקסין אלפא עשויים להשתנות בהתאם למנגנון המדויק של האוליגומריזציה ולאינטראקציות הספציפיות בין מולקולות רעלן. עם זאת, ניתן לתאר כמה עקרונות כלליים בהתבסס על מוטיבים ידועים של אינטראקציה בין חלבון לחלבון ותכונות מבניות של הרעלן:
שיירים הידרופוביים: שיירים הידרופוביים, כגון לאוצין (Leu), איזולאוצין (Ile) ו-Valine (Val), נמצאים בדרך כלל בממשקי אוליגומריזציה ותורמים ליציבות של אינטראקציות חלבון-חלבון. שיריים אלה יכולות ליצור מגעים הידרופוביים עם שיירים משלימים על מולקולות רעלנים שכנות, ולקדם את ההרכבה של קומפלקסים גדולים של רעלנים.
שיירים ארומטיים: שיירים ארומטיים, כגון פנילאלנין (Phe), טירוזין (Tyr) וטריפטופן (Trp), מעורבים לעתים קרובות גם באינטראקציות בין חלבון לחלבון. שיירים אלה יכולים ליצור קשרי מימן עם שיירים ארומטיים או קוטביים אחרים, התורמים ליציבותם של הקומפלקסים.
קשרי דיסולפיד: שיירי ציסטאין בתוך רעלן אלפא עשויים להשתתף ביצירת קשרי דיסולפיד בין מולקולות רעלנים, תוך ייצוב המבנה האוליגומרי. קשרי דיסולפיד יכולים לקשר באופן קוולנטי שיריים של ציסטאין על מולקולות רעלנים שונות, ולספק יציבות נוספת לקומפלקס האוליגומרי.
אינטראקציות אלקטרוסטטיות: שיירים טעונים, כגון ליזין (Lys), ארגינין (Arg), גלוטמט (Glu) ואספרטט (Asp), יכולים גם למלא תפקיד בתיווך אינטראקציות חלבון-חלבון באמצעות אינטראקציות אלקטרוסטטיות. שיירים טעונים משלימים בממשקי אוליגומריזציה עלולים ליצור גשרי מלח או אינטראקציות אלקטרוסטטיות אחרות, התורמות ליציבות הקומפלקס האוליגומרי.
PLAT - Polycystin-1, Lipoxygenase, Alpha toxin
אזור המצוי במיקום 284-398 חומצות אמינו[5]. אזור זה הוא אלמנט מבני הנמצא בחלבונים שונים כמו באלפא טוקין מ- Clostridium perfringens. אזור זה נקרא על שם נוכחותו בחלבון הפוליצסטין- 1, ליפוגנאזות ורעלני אלפא. תחום ה- PLAT ומעורב בתפקודים מגוונים על פני חלבונים שונים. במקרה של אלפא טוקסין מ- Clostridium perfringens, תחום ה-PLAT ממוקם באזור ה-C-terminal של הרעלן. הוא אחראי על קשירת ממברנה ואוליגומריזציה, שלבי מפתח במנגנון הפעולה של הרעלן. באופן ספציפי, תחום ה-PLAT מקל על האינטראקציה של רעלן אלפא עם דו-שכבת השומנים של קרומי התא, ומאפשר לרעלן להחדיר לתוך הממברנה ולהפעיל את פעילות הפוספוליפאז שלו. תחום ה-PLAT נחשב כיוצר קיפול beta sheet, המורכב ממספר גדילי בטא המסודרים במבנה דמוי סנדוויץ'. קפל זה מיוצב על ידי קשרי דיסולפיד ואינטראקציות אחרות בתוך החלבון. תחום ה-PLAT של אלפא טוקסין תורם ליציבות ולתפקוד הכלליים של הרעלן, ומאפשר לו לשבש ביעילות את ממברנות התא ולגרום לנזק לרקמות. הבנת המבנה והתפקוד של תחום ה-PLAT ברעלן אלפא חיונית להבהרת מנגנוני פעולת הרעלנים ולפיתוח אסטרטגיות למיקוד ועיכוב פעילותו של הרעלן בזיהומי Clostridium perfringens.
פוספוליפאז תלוי אבץ
נמצא במיקום 26-278 בחלבון. אזור זה הוא אזור שמור של 11 שיירים, המכיל שלושה אזורי קושרי אבץ: היסטדין המעורב בקשירת יון האבץ הראשון, חומצה אספרטית הקושרת את יון האבץ הראשון והשלישי והיסטדין הקושר את יון האבץ השני. יוני אבץ הם קופקטורים חיוניים לפעילות האנזימטית של הטוקסין. נוכחות של יוני אבץ בטוקסין היא קריטית לייצוב המבנה השלישוני של החלבון ופעילות הפוספוליפאז.
קשרי SS לייצוב המבנה השלישוני של החלבון
שיירי ציסטאין חשובים לייצוב המבנה השלישוני של החלבון באמצעות יצירת קשרים דיסולפידים. קשרי דיסולפיד הם קשרים קוולנטיים הנוצרים בין שני שיירי ציסטאין כאשר קבוצות התיול שלהם (-SH) עוברות חמצון, וכתוצאה מכך קישור של אטומי גופרית ליצירת גשר דיסולפיד (-S-S-). קשרי דיסולפיד אלו ממלאים תפקיד מכריע בשמירה על היציבות הכללית ושלמות המבנית של הרעלן. המיקום הספציפי של שיירי ציסטאין בחלבון אלפא טוקסין יכול להשתנות בהתאם לרצף המדויק של הרעלן. עם זאת, רעלן אלפא מכיל בדרך כלל שיירי ציסטאין מרובים המפוזרים לאורך הרצף שלו. עבור טוקסין אלפא ידוע שחלק משייירי הציסטאין נמצאים באזור C- טרמינלי של החלבון, המכיל את תחום ה-PLAT האחראי על קשירת הממברנה. שיירי ציסטאין אלו תורמים לייצוב תחום ה-PLAT ולאינטראקציה שלו עם הפוספוליפידים של ממברנות התא המארח. בנוסף, שיירי ציסטאין עשויים להיות נוכחים גם באזורים אחרים של חלבון אלפא טוקסין, לרבות תחום ה-N טרמינלי, המציג פעילות של פוספוליפאז C. שיירי ציסטאין אלה עשויים להשתתף ביצירת קשרים דיסולפידים תוך מולקולריים, התורמים לקיפול וליציבות הכללית של החלבון.
מחלות שנגרמות על ידי חיידקי הכלוסטרידיום
רעלן אלפא של חיידק הכלורידיום קשור למספר מחלות בבני האדם ובע"ח אחרים[6]:
נמק גזי: זיהום חמור שעלול לסכן חיים, המאופיין בהרס רקמות מהיר וייצור גז ברקמות שנפגעו. המחלה מאופיינת בכאב עז במקום הזיהום, בצקת, שינויים בצבע הרקמה לגוונים של חום, הפרשה מן הפצע, שלפוחיות וגז ברקמה. את הגז ניתן לחוש בלחץ קל על האזור הנגוע. התחושה היא של ספוג רק המלא בחללי אוויר. בהמשך מופיע נמק בעיקר של רקמת שריר, חום, סימנים של הלם זיהומי. התמותה מן המחלה גבוהה – 25% במקרים הקשורים לחבלה ומעל 70% במקרים ללא חבלה.
הרעלת מזון כלוסטרידיאלית: חיידקים הכלוסטרידיום הם אחד הגורמים המובילים להרעלת מזון ממקור חיידקי ברחבי העולם. בליעת החיידקים יחד עם הרעלנים שלהם, עלולה להוביל לתסמינים כמו התכווצויות בטן ושלשולים, טשטוש ראיה, יובש בפה, אישורים מקובעים. המחלה חולפת בדרך כלל תוך 24 שעות. חומרת התסמינים קשורה בכמות הרעלן שנאכל. :
דלקת מעיים נמקית: דלקת מעיים נמקית בבעלי חיים: בבעלי חיים, במיוחד בעופות, זיהומי חיידקי הכלוסטרידיום יכולים להוביל לדלקת מעיים נמקית, מחלת מעיים קשה המאופיינת בדלקת ונמק של רירית המעי. רעלן אלפא, יחד עם רעלנים נוספים המיוצרים על ידי החיידק, תורמים לנזק לרקמות ולהתקדמות המחלה בבעלי חיים שנפגעו.
ספטיסמיה(אלח דם): חיידקים הכלוסטרידיום עלולים להשפיע על מערכות הגוף, הלם ואי ספיקת איברים מרובה. מצבים אלה נגרמים בדרך כלל בעקבות תגובת יצר של מערכת החיסון. תסמיני מצבים אלה הם קצב לב מהיר, נשימה מהירה, צמרמורת, ובמצבים חמורים ירידה בנפח השתן, שינוי חד במצב ההכרה, ירידה בספירת טסיות הדם, קשיי נשימה ושלשולים ובחילות. זיהומים מערכתיים אלה עלולים להיות מסכני חיים ודורשים התערבות רפואית מיידית. אבחון בשלב מוקדם, טרם פגיעה באיברים חיוניים, מאפשר טיפול באנטיביוטיקה בלבד, ללא אשפוז.
מנגנון המחלה
מנגנון המחלה הקשור לרעלן אלפא בחיידקי הכלוסטרידיום כולל מספר שלבים שבסופו של דבר מובילים לנזק לרקמות, לנמק ולהשפעות פתולוגיות אחרות.לכל המחלות מנגנון דומה:
1. התיישבות של חיידקים וייצור רעלים: חיידקי הכלוסטרידיום מתיישבים על הרקמה (פצעים, מערכת עיכול ועוד). לאחר ההתיישבות מתחילים החיידקים לשחרר רעלנים לסביבה.
2. דיפוזיה וקשירת רעלנים: רעלן אלפא ורעלים אחרים המיוצרים על ידי Clostridium perfringens מתפזרים דרך רקמות ונקשרים לקולטנים ספציפיים על פני התאים המארחים. רעלן אלפא, למשל, נקשר לפוספוליפידים בממברנת התא.
3. שיבוש הממברנה: לאחר היקשרות אלפא טוקסין לממברנת התא, הוא מפעיל את מנגנון הפוספוליפאז (אנזים המפרק פוספוליפידים) ומשבש את ממברנת התא. בתוך הממברנה נפתחות נקבוביות ודרכן דולף התוכן התאי והתא מת.
4. נזק לרקמות ונמק: מוות נרחב של תאים גורם לנזק לרקמה ולנמק באתר הזיהום. נמק זה יכול להיות חמור, ולהוביל להשחרה של הרקמה כתוצאה מהיווצרות של גזים רעילים.
5. תגובה דלקתית: שחרור הרעלנים החיידקיים ופסולת תאים מעוררת תגובה דלקתית המאופיינת בגיוס תאי מערכת חיסון לאתר הזיהום. תגובה דלקתית זו גורמת נזק נוסף לרקמה ולדלקת.
השפעות רחבות: במקרים חמורים התפשטות רעלני חיידקים ומתווכים דלקתיים לזרם הדם עלולה להוביל להשפעות מערכתיות, כגון ספטיסמיה (הרעלת דם), הלם ואי ספיקת איברים מרובה. השפעות מערכתיות אלו עלולות להיות מסכנות חיים ודורשות התערבות רפואית מיידית.
</p>
מקורות מידע
- ↑ https://academic.oup.com/jb/article/136/5/569/899707?login=true
- ↑ מנגנון
- ↑ https://journals.asm.org/doi/full/10.1128/mbio.00019-13
- ↑ https://pubs.acs.org/doi/full/10.1021/bi051805s
- ↑ https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4814171/
- ↑ https://www.futuremedicine.com/doi/full/10.2217/fmb.13.168