This old version of Proteopedia is provided for student assignments while the new version is undergoing repairs. Content and edits done in this old version of Proteopedia after March 1, 2026 will eventually be lost when it is retired in about June of 2026.
Apply for new accounts at the new Proteopedia. Your logins will work in both the old and new versions.
2vpu French
From Proteopedia
| |||||||
| 2vpu, resolution 1.90Å () | |||||||
|---|---|---|---|---|---|---|---|
| Sites: | , , , , and | ||||||
| Ligands: | , , | ||||||
| |||||||
| Resources: | FirstGlance, OCA, PDBsum, RCSB | ||||||
| Coordinates: | save as pdb, mmCIF, xml | ||||||
STRUCTURE 3D DE LA TET3 DE PYROCOCCUS HORIKOSHII
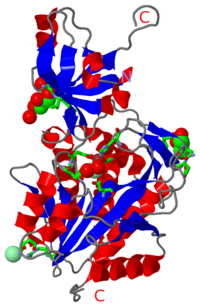
La structure 3D d'un complexe peptidasique de 468 kDa de l'hyperthermophile Pyrococcus horikoshi a été résolue à une résolution de 1.9 A. Le monomère contient le domaine catalytique typique des M42 peptidases, et un domaine de dimérisation qui permet la formation de dimères qui s'assemblent comme un tétraèdre auto-compartimenté à 12 sous-unités, semblable à ceux décrits pour les TET peptidases. L'analyse biochimique montre que l'enzyme est activée par le cobalt et qu'elle clive des peptides par un mécanisme non-processif. Par conséquent, cette protéine représente le troisième complexe TET peptidasique décrit dans P. horikoshii, donc nommé PhTET3. C'est une lysyl aminopeptidase avec une préférence élevée pour des résidus basiques, qui sont mal clivés par la PhTET1 et la PhTET2. L'analyse structurale de la PhTET3 et sa comparaison avec la PhTET1 et la PhTET2 révèle des caractéristiques communes qui expliquent le mode général d'action des machines moléculaires TET, ainsi que des différences qui peuvent être associées à de fortes discriminations des substrats. La question de la stabilité des assemblages TET à des températures extrêmes a été étudiée. La PhTET3 possède une activité maximale à 95 degrés C et des expériences de diffusion de neutrons à petits angles réalisées à 90 degrés C démontrent l'absence d'altérations de la structure quaternaire après des temps d'incubation importants. En conclusion, les PhTET sont des machines de destruction de peptides complémentaires, qui jouent un role important dans le métabolisme de P. horikoshii.
Structure of quinoprotein methylamine dehydrogenase at 2.25 A resolution., Vellieux FM, Huitema F, Groendijk H, Kalk KH, Jzn JF, Jongejan JA, Duine JA, Petratos K, Drenth J, Hol WG, EMBO J. 1989 Aug;8(8):2171-8. PMID:2792083
From MEDLINE®/PubMed®, a database of the U.S. National Library of Medicine.
Résumé traduit de MEDLINE®/PubMed®, une base de données de la U.S. National Library of Medicine.
Au sujet de cette Structure
2VPU est une structure à une chaine de séquence de Pyrococcus horikoshii. Des informations cristallographiques complètes sont disponibles sur OCA.
Référence
- Dura MA, Rosenbaum E, Larabi A, Gabel F, Vellieux FM, Franzetti B. The structural and biochemical characterizations of a novel TET peptidase complex from Pyrococcus horikoshii reveal an integrated peptide degradation system in hyperthermophilic Archaea. Mol Microbiol. 2009 Apr;72(1):26-40. Epub 2009 Mar 5. PMID:19291145 doi:10.1111/j.1365-2958.2009.06600.x
Page seeded by OCA on Wed Apr 15 09:25:54 2009