User:Nathália Gagliardi Saldys/Sandbox 1
From Proteopedia
Contents |
HDAC6 - Estrutura e função
Sobre a proteína e suas funções
|
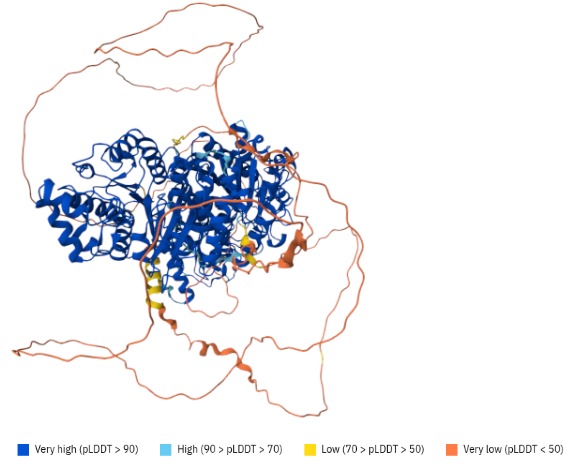
A HDAC 6 (Figura 1) é uma proteína citoplasmática da família HDAC e tem como principal função a desacetilação de uma ampla gama de substratos, com destaque para proteínas não histônicas. Entre os substratos conhecidos estão α-tubulina, cortactina, Hsp90, peroxirredoxina e Tat.
Figura 1. Estrutura da proteína HDAC6. Modelo preescrito pelo Alpha Fold: https://alphafold.ebi.ac.uk/entry/Q9UBN7
A HDAC 6 pode se associar aos microtúbulos e desacetilar a proteína α-tubulina catalisando a remoção do grupo acetil (Figura 2). Essa desacetilação mediada por HDAC6 regula a motilidade celular dependente de microtúbulos. Além disso, essa acetilação reversível regula importantes processos biológicos como metabolismo de histonas, transcrição gênica e desmontagem dos cílios, importante para a regulação da homeostase ciliar.
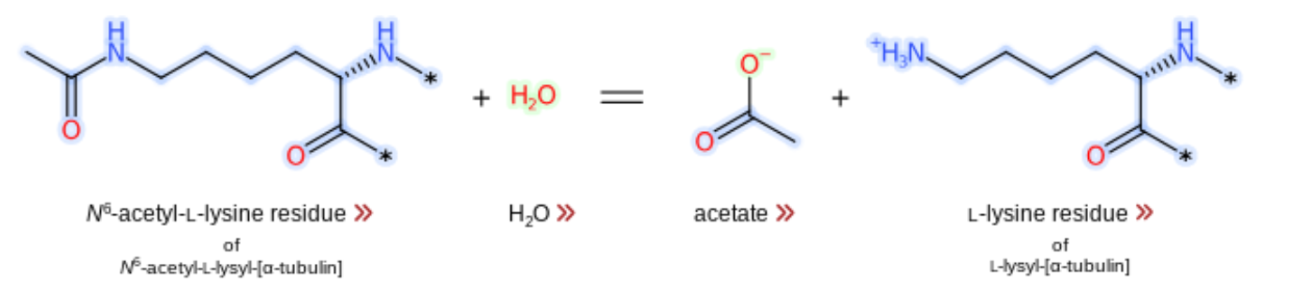 Figura 2. Desacetilação da α-tubulina
Figura 2. Desacetilação da α-tubulina
E além dessa função de desacetilação, essa proteína desempenha um papel fundamental na degradação de proteínas mal dobradas: quando proteínas mal dobradas são abundantes demais para serem degradadas pelo sistema de redobramento de chaperonas e pelo ubiquitina-proteassoma, a HDAC6 auxilia na sua eliminação por vias alternativas, como a autofagia. Além disso, a HDAC6 está envolvida na regulação epigenética associada à progressão de alguns tipos de câncer.
Perante essas diversas funções é de enorme importância conhecer melhor a estrutura dessa proteína e correlacionar cada domínio catalítico com alguma de suas funções, até para desenvolvimento de possíveis fármacos.
Estrutura da proteína relacionada à função catalítica (desacetilação)
A HDAC 6 é única dentro da família das histonas desacetilases por apresentar um domínio catalítico duplo ( e ). Ambos são capazes de realizar a função de desacetilação, mas o CD2 (domínio catalítico 2) é o principal responsável pela desacetilação de proteínas não histônicas, como a α-tubulina.
A HDAC6 catalisa a desacetilação de K40 (Lisina 40) na subunidade α-tubulina do microtúbulo, regulando assim a dinâmica dos microtúbulos: a inibição do HDAC6 leva à hiperacetilação da α-tubulina e à supressão da dinâmica dos microtúbulos, enquanto a superexpressão do HDAC6 reduz a acetilação da tubulina e aumenta a motilidade celular.
Ela é uma HDAC de classe IIb, enzimas dependentes de íons Zn2+, que são essenciais para a catálise: o Zn²⁺ polariza a carbonila do grupo acetilado, facilitando seu ataque por uma molécula de água ativada (ataque nucleofílico), o que remove o grupo acetil da lisina.
Estudos com estruturas cristalinas de raios X de HDAC6 e HDAC6 CD1 e , revelaram que a enzima do peixe-zebra possui uma conservação estrutural significativa e pode ser usada como substituto funcional da enzima humana para análises estruturais.
Esses mesmos estudos mostram que o domínio CD2 apresenta um , além de uma molécula de , formando parte do sítio catalítico.
Mecanismo Catalítico
As hidrolases de zinco ativam um grupo carbonila do substrato para ataque nucleofílico direto por uma molécula de água usando coordenação Zn2 + e uma interação de ligação de hidrogênio para polarizar o grupo carbonila; a molécula de água nucleofílica é ativada pela coordenação Zn2 + e uma base geral. Logo, a carbonila do grupo acetilado na lisina é polarizada por interações com o Zn²⁺ e uma base geral, o que facilita o ataque nucleofílico por uma molécula de água ativada — mecanismo típico de hidrolases de zinco.
Em resumo, o objetivo de uma desacetilase é remover o grupo acetil (–COCH₃) de uma lisina acetilada (Ac-Lys) presente em proteínas como α-tubulina. Na primeira etapa desse processo a lisina acetilada do substrato é encaixada no domínio CD2 e o . Em seguida, o grupo carbonila (C=O) do grupo acetil interage com o íon Zn²⁺, polarizando o carbono carbonílico (o tornando mais eletrofílico). Ao mesmo tempo, um resíduo de base geral desprotona uma molécula de H₂O, gerando um íon hidroxila (OH⁻) reativo, o qual ataca o carbono da carbonila do grupo acetil, formando um intermediário tetraédrico. Esse intermediário colapsa e libera um acetato (CH₃COO⁻), assim, a lisina fica desacetilada e é liberada do sítio ativo.
Referências
UNIPROT. Q9UBN7 – Histone deacetylase 6 (HDAC6) [Homo sapiens]. Disponível em: https://www.uniprot.org/uniprotkb/Q9UBN7/entry. Acesso em: 10 jun. 2025.
EUROPEAN BIOINFORMATICS INSTITUTE. AlphaFold Protein Structure Database – HDAC6 (Q9UBN7). Disponível em: https://alphafold.ebi.ac.uk/entry/Q9UBN7. Acesso em: 10 jun. 2025.
HUBBERT, C.; GUARDIOLA, A.; SHAO, R. et al. HDAC6 is a microtubule-associated deacetylase. Nature, [S.l.], v. 417, n. 6887, p. 455–458, 2002. DOI: 10.1038/417455a. Disponível em: https://pubmed.ncbi.nlm.nih.gov/12024216/. Acesso em: 10 jun. 2025.
RAN, J. et al. Deacetylation of α-tubulin and cortactin is required for HDAC6 to trigger ciliary disassembly. Scientific Reports, [S.l.], v. 5, p. 12917, 2015. DOI: 10.1038/srep12917. Disponível em: https://pubmed.ncbi.nlm.nih.gov/26246421/. Acesso em: 10 jun. 2025.
HAI, Y.; CHRISTIANSON, D. W. Histone deacetylase 6 structure and molecular basis of catalysis and inhibition. Nature Chemical Biology, [S.l.], v. 12, n. 9, p. 741–747, 2016. DOI: 10.1038/nchembio.2134. Disponível em: https://www.nature.com/articles/nchembio.2134. Acesso em: 10 jun. 2025.