User:María Sánchez Morán/TFGParte1
From Proteopedia
| (5 intermediate revisions not shown.) | |||
| Line 1: | Line 1: | ||
{| | {| | ||
| - | < | + | <p style="font-size 16px;text-align:center;"> |
| + | [[User:María Sánchez Morán/TFG | Índice]] | | ||
| + | [[User:María Sánchez Morán/TFGParte2 | Página Siguiente >>]] | ||
| + | </p> | ||
| + | |||
| + | <div style=;position:relative;margin-left:auto;margin-right:auto;padding:10px;border:1px solid #ededed;background-color:#FFFAFA;box-shadow:0px 0px 10px #ededed;"> | ||
| + | <div id="punto0"></div> | ||
<p style="font-size:20px;border-bottom:1px solid #ac9de3;background-color:#E0DEFF;padding:5px;"> Resumen/Abstract</p> | <p style="font-size:20px;border-bottom:1px solid #ac9de3;background-color:#E0DEFF;padding:5px;"> Resumen/Abstract</p> | ||
<div style="background-color:#F1F1FF;"> | <div style="background-color:#F1F1FF;"> | ||
| + | |||
La fotólisis del agua es una reacción imprescindible para la vida en la Tierra. Consiste en una oxidación catalizada por el centro de formación de oxígeno (OEC), un complejo Mn<sub>4</sub>CaO<sub>5</sub> localizado en el fotosistema II de los organismos fotosintéticos. | La fotólisis del agua es una reacción imprescindible para la vida en la Tierra. Consiste en una oxidación catalizada por el centro de formación de oxígeno (OEC), un complejo Mn<sub>4</sub>CaO<sub>5</sub> localizado en el fotosistema II de los organismos fotosintéticos. | ||
| Line 24: | Line 31: | ||
'''Keywords:''' catalysis, oxygen-evolving complex, photosystem II, S-state cycle, structure. | '''Keywords:''' catalysis, oxygen-evolving complex, photosystem II, S-state cycle, structure. | ||
| - | <p style="font-size:20px;border-bottom:1px solid #ac9de3;background-color:#E0DEFF;padding:5px;">1. Introducción</p> | ||
<div id="punto1"></div> | <div id="punto1"></div> | ||
| + | <p style="font-size:20px;border-bottom:1px solid #ac9de3;background-color:#E0DEFF;padding:5px;">1. Introducción</p> | ||
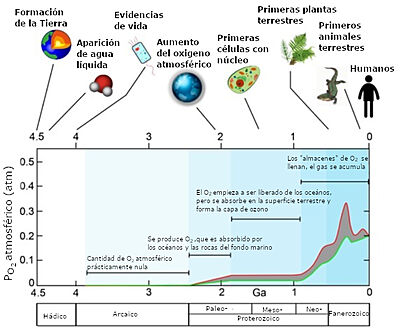
| + | [[Image:Fig1 MSM.jpg|thumb|400px|right| Fig. 1. Estimación superior (curva roja) e inferior (curva verde) de la cantidad de oxígeno acumulado en la atmosfera en una escala de miles de millones de años (Ga) y acontecimientos relevantes para el desarrollo de la vida en la Tierra. Adaptado de 3]] | ||
| + | <div id="punto11"></div> | ||
| + | <p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">1.1. Origen de los organismos fotosintéticos</p> | ||
| + | |||
| + | La gran cantidad de O<sub>2</sub> atmosférico distingue a la Tierra de los demás planetas del sistema solar y permite la existencia de los diferentes seres vivos en su superficie. Sin embargo, la atmósfera no siempre ha tenido esta composición. [1] Hace aproximadamente 3500 millones de años, la aparición de una metaloenzima capaz de fragmentar una molécula de H<sub>2</sub>O en O<sub>2</sub>, protones y electrones supuso un cambio drástico en la composición de la atmósfera. (Fig. 1) [2] Este hecho produjo una extinción masiva de las formas de vida existentes, para las que el oxígeno era un tóxico. Por otro lado, hubo un desarrollo de algunos organismos que utilizaban este oxígeno en su metabolismo, que fueron evolucionando hacia seres más complejos con células eucariotas y multicelulares. [3] | ||
| - | <p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">1.1. Origen de los organismos fotosintéticos</p><div id="punto11"></div> | ||
| - | La gran cantidad de O<sub>2</sub> atmosférico distingue a la Tierra de los demás planetas del sistema solar y permite la existencia de los diferentes seres vivos en su superficie. Sin embargo, la atmósfera no siempre ha tenido esta composición. [1] Hace aproximadamente 3500 millones de años, la aparición de una metaloenzima capaz de fragmentar una molécula de H<sub>2</sub>O en O<sub>2</sub>, protones y electrones supuso un cambio drástico en la composición de la atmósfera. [2] Este hecho produjo una extinción masiva de las formas de vida existentes, para las que el oxígeno era un tóxico. Por otro lado, hubo un desarrollo de algunos organismos que utilizaban este oxígeno en su metabolismo, que fueron evolucionando hacia seres más complejos con células eucariotas y multicelulares. [3] | ||
| - | <p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">1.2. Metaloenzimas</p> | ||
<div id="punto12"></div> | <div id="punto12"></div> | ||
| + | <p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">1.2. Metaloenzimas</p> | ||
| + | |||
Las metaloenzimas son macromoléculas formadas por un metal que actúa como ácido de Lewis y una proteína actuando como base de Lewis que tienen actividad enzimática. La funcionalidad de las diferentes biomoléculas es consecuencia de las estructuras y de la naturaleza metálica de cada caso. Así, los cambios conformacionales de las cadenas proteicas y las interacciones existentes en la biomolécula son los responsables de la acción del centro activo metálico. | Las metaloenzimas son macromoléculas formadas por un metal que actúa como ácido de Lewis y una proteína actuando como base de Lewis que tienen actividad enzimática. La funcionalidad de las diferentes biomoléculas es consecuencia de las estructuras y de la naturaleza metálica de cada caso. Así, los cambios conformacionales de las cadenas proteicas y las interacciones existentes en la biomolécula son los responsables de la acción del centro activo metálico. | ||
| Line 38: | Line 49: | ||
Los seres vivos dependen casi exclusivamente de las metalobiomoléculas para producir, a velocidades significativas, los procesos de transferencia electrónica necesarios en los organismos. Las consideraciones termodinámicas en este caso vienen dadas por los potenciales redox. Los diferentes ligandos y geometrías afectan al carácter redox del metal y al potencial redox del par. En cuanto a las consideraciones cinéticas, la biomolécula ofrece un entorno preformado al metal, determinado por el número y la orientación de los grupos dadores, que produce un estado entático: una situación energética muy favorable para que tenga lugar la reacción. | Los seres vivos dependen casi exclusivamente de las metalobiomoléculas para producir, a velocidades significativas, los procesos de transferencia electrónica necesarios en los organismos. Las consideraciones termodinámicas en este caso vienen dadas por los potenciales redox. Los diferentes ligandos y geometrías afectan al carácter redox del metal y al potencial redox del par. En cuanto a las consideraciones cinéticas, la biomolécula ofrece un entorno preformado al metal, determinado por el número y la orientación de los grupos dadores, que produce un estado entático: una situación energética muy favorable para que tenga lugar la reacción. | ||
| - | <p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">1.3. Centro de formación de oxígeno (OEC)</p> | ||
<div id="punto13"></div> | <div id="punto13"></div> | ||
| + | <p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">1.3. Centro de formación de oxígeno (OEC)</p> | ||
| + | |||
Cuando se comparan cianobacterias, algas y plantas contemporáneas, se observan un mismo centro inorgánico y un núcleo proteico similar en el centro activo de la enzima, lo que sugiere la creación natural de un único tipo de fotocatalizador hace unos 3500 millones de años llamado fotosistema II (PSII), [2] constituido por un complejo de múltiples subunidades proteicas que se localiza en el entorno lipídico de la membrana tilacoidal de algas, plantas y cianobacterias. [4] | Cuando se comparan cianobacterias, algas y plantas contemporáneas, se observan un mismo centro inorgánico y un núcleo proteico similar en el centro activo de la enzima, lo que sugiere la creación natural de un único tipo de fotocatalizador hace unos 3500 millones de años llamado fotosistema II (PSII), [2] constituido por un complejo de múltiples subunidades proteicas que se localiza en el entorno lipídico de la membrana tilacoidal de algas, plantas y cianobacterias. [4] | ||
El centro activo donde se produce la oxidación del H<sub>2</sub>O se conoce como complejo de formación de oxígeno (por sus iniciales en inglés, OEC, Oxygen Evolving Complex) y consiste en una pequeña agrupación de átomos o clúster formado por cuatro átomos de manganeso y un átomo de calcio unidos mediante átomos de oxígeno (Mn<sub>4</sub>CaO<sub>5</sub>). [5] | El centro activo donde se produce la oxidación del H<sub>2</sub>O se conoce como complejo de formación de oxígeno (por sus iniciales en inglés, OEC, Oxygen Evolving Complex) y consiste en una pequeña agrupación de átomos o clúster formado por cuatro átomos de manganeso y un átomo de calcio unidos mediante átomos de oxígeno (Mn<sub>4</sub>CaO<sub>5</sub>). [5] | ||
| - | <p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">1.4. Importancia del proceso enzimático | + | <div id="punto14"></div> |
| - | + | <p style="font-size:16px;border-bottom:1px solid #ac9de3;background-color:#eae8f5;padding:3px;text-indent:5px;">1.4. Importancia del proceso enzimático</p> | |
La oxidación de la molécula de agua es una reacción difícil debido a la gran fortaleza de sus enlaces covalentes, reforzados por cierto carácter iónico resultado de la diferencia de electronegatividades existente entre los átomos de hidrógeno y el de oxígeno. | La oxidación de la molécula de agua es una reacción difícil debido a la gran fortaleza de sus enlaces covalentes, reforzados por cierto carácter iónico resultado de la diferencia de electronegatividades existente entre los átomos de hidrógeno y el de oxígeno. | ||
| Line 55: | Line 67: | ||
Tampoco está favorecido desde el punto de vista cinético, debido a que la formación de O<sub>2</sub> a partir de H<sub>2</sub>O es un proceso que necesita movilizar cuatro electrones. [5] | Tampoco está favorecido desde el punto de vista cinético, debido a que la formación de O<sub>2</sub> a partir de H<sub>2</sub>O es un proceso que necesita movilizar cuatro electrones. [5] | ||
| - | <p style="font-size:20px;border-bottom:1px solid #ac9de3;background-color:#E0DEFF;padding:5px;">2. Materiales y métodos</p> | ||
<div id="punto2"></div> | <div id="punto2"></div> | ||
| + | <p style="font-size:20px;border-bottom:1px solid #ac9de3;background-color:#E0DEFF;padding:5px;">2. Materiales y métodos</p> | ||
Se ha realizado una búsqueda sistemática sobre el tema utilizando la base de datos SciFinder-n empleando las palabras clave “photosystem II”, “OEC”, “oxygen evolving complex” y “S-state cycle”, combinadas en algunos casos con “structure” y “function”. Los resultados de estas búsquedas fueron acotados en base al año de publicación y al número de citas. | Se ha realizado una búsqueda sistemática sobre el tema utilizando la base de datos SciFinder-n empleando las palabras clave “photosystem II”, “OEC”, “oxygen evolving complex” y “S-state cycle”, combinadas en algunos casos con “structure” y “function”. Los resultados de estas búsquedas fueron acotados en base al año de publicación y al número de citas. | ||
| Line 68: | Line 80: | ||
Además, se ha preparado una versión en línea, complementaria a la memoria impresa, disponible en el portal Proteopedia, al que se puede acceder a través de: https://proteopedia.org/w/User:María_Sánchez_Morán/TFG | Además, se ha preparado una versión en línea, complementaria a la memoria impresa, disponible en el portal Proteopedia, al que se puede acceder a través de: https://proteopedia.org/w/User:María_Sánchez_Morán/TFG | ||
| - | <p style="font-size | + | <p style="font-size 16px;text-align:center;"> |
[[User:María Sánchez Morán/TFG | Índice]] | | [[User:María Sánchez Morán/TFG | Índice]] | | ||
[[User:María Sánchez Morán/TFGParte2 | Página Siguiente >>]] | [[User:María Sánchez Morán/TFGParte2 | Página Siguiente >>]] | ||