Sandbox pah
From Proteopedia
| Line 17: | Line 17: | ||
<scene name='Sandbox_pah/Pah_monomer_with_bh4_and_fe/5'> לחץ כאן </scene> לצפיה באתר הפעיל בהגדלה - שים לב ליון הברזל המסומן בורוד ).האיזור מסומן בירוק על התמונה </div> | <scene name='Sandbox_pah/Pah_monomer_with_bh4_and_fe/5'> לחץ כאן </scene> לצפיה באתר הפעיל בהגדלה - שים לב ליון הברזל המסומן בורוד ).האיזור מסומן בירוק על התמונה </div> | ||
| - | <div dir='rtl'> 3. דומיין האוליגומריזציה (מחומצה אמינית 411 ועד לחומצה אמינית 452 הנמצאת בקצה ה-C טרמינלי של השרשרת) - מרכב משני משטחי ביתא אנטי מקבילים ומסליל אלפא אחד.האיזור מסומן בכחול על התמונה </div> | + | <div dir='rtl'> 3. דומיין האוליגומריזציה (מחומצה אמינית 411 ועד לחומצה אמינית 452 הנמצאת בקצה ה-C טרמינלי של השרשרת) - מרכב משני משטחי ביתא אנטי מקבילים ומסליל אלפא אחד.האיזור מסומן בכחול על התמונה (6,7,8) </div> |
[[Image:Pah.png|250px ]] | [[Image:Pah.png|250px ]] | ||
| Line 31: | Line 31: | ||
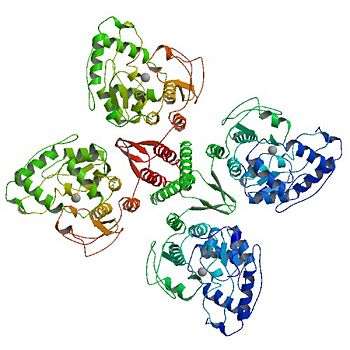
====<div dir='rtl'> המבנה הרביעוני של פנילאלנין הידרוקסילאז </div>==== | ====<div dir='rtl'> המבנה הרביעוני של פנילאלנין הידרוקסילאז </div>==== | ||
| - | <div dir='rtl'>מבנה רביעוני של חלבון נוצר כאשר שרשרות חלבון בעלות מבנה שלישוני מתאחדות ויוצרות אוליגומר. פנילאלנין הידרוקסילאז מאופיין בשני מבנים רביעונים פעילים הנמצאים בשוו"מ - מבנה של <scene name='Sandbox_pah/Dimer_pah/1'>דימר </scene> ומבנה של טטרמר (מודל של טטרמר מופיע בתמונה השמאלית למעלה). שני המבנים פעילים בזירוז התגובה להפיכת פנילאלנין לטירוזין, אך פעילותו של הדימר יעילה פחות מזו של הטטרמר. </div> צפיה בדימר ובטטרמר מאפשרת הבנה של האופן בו נוצר המבנה הרביעוני של פניל אלנין הידרוקסילאז. כאמור, בדומיין האחראי לאוליגומריזציה ישנו סליל אלפא. בתהליך יצירת הדימר והטטרמר נצמדים סלילי האלפא של המונומרים השונים אלו לאלו ובאמצעות שחלוף דומיינים יוצרים מבנה של סליל מלופף. באופן הזה מתקבל מבנה רביעוני פעיל של החלבון פנילאלנין הידרוקסילאז, ומתאפשר תפקודו כזרז.</div> | + | <div dir='rtl'>מבנה רביעוני של חלבון נוצר כאשר שרשרות חלבון בעלות מבנה שלישוני מתאחדות ויוצרות אוליגומר. פנילאלנין הידרוקסילאז מאופיין בשני מבנים רביעונים פעילים הנמצאים בשוו"מ - מבנה של <scene name='Sandbox_pah/Dimer_pah/1'>דימר </scene> ומבנה של טטרמר (מודל של טטרמר מופיע בתמונה השמאלית למעלה). שני המבנים פעילים בזירוז התגובה להפיכת פנילאלנין לטירוזין, אך פעילותו של הדימר יעילה פחות מזו של הטטרמר. </div> צפיה בדימר ובטטרמר מאפשרת הבנה של האופן בו נוצר המבנה הרביעוני של פניל אלנין הידרוקסילאז. כאמור, בדומיין האחראי לאוליגומריזציה ישנו סליל אלפא. בתהליך יצירת הדימר והטטרמר נצמדים סלילי האלפא של המונומרים השונים אלו לאלו ובאמצעות שחלוף דומיינים יוצרים מבנה של סליל מלופף. באופן הזה מתקבל מבנה רביעוני פעיל של החלבון פנילאלנין הידרוקסילאז, ומתאפשר תפקודו כזרז.(7)</div> |
===<div dir='rtl'> פעילות האנזים פנילאלנין הידרוקסילאז וחשיבותו </div>=== | ===<div dir='rtl'> פעילות האנזים פנילאלנין הידרוקסילאז וחשיבותו </div>=== | ||
| Line 56: | Line 56: | ||
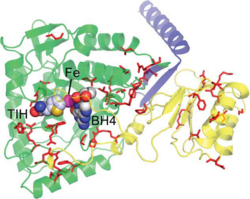
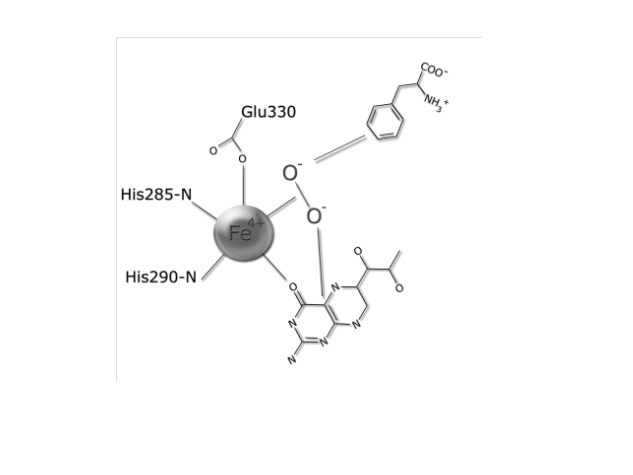
היסטידין His 285 וטריפטופן Trp326 יוצרות אינטראקציות π-π בין טבעות הבנזניות שלהן ואלה של הסובסטראט (פנילאלנין), וארגינין Arg270 , סרין Ser349 ותראונין Thr278 מגיבות עם הקבוצות הטעונות של הסובסטראט. האינטראקציות גורמות לכך שפנילאלנין מקבל כיווניות מתתאימה להמשך התגובה. | היסטידין His 285 וטריפטופן Trp326 יוצרות אינטראקציות π-π בין טבעות הבנזניות שלהן ואלה של הסובסטראט (פנילאלנין), וארגינין Arg270 , סרין Ser349 ותראונין Thr278 מגיבות עם הקבוצות הטעונות של הסובסטראט. האינטראקציות גורמות לכך שפנילאלנין מקבל כיווניות מתתאימה להמשך התגובה. | ||
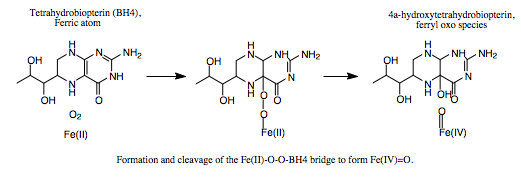
יון הברזל בא בין החנקן בחומצות אמיניות היסטידין His285 ו- His290 לבין חמצן בחומצה אמינית Glu330. מולקולת החמצן נקשרת לקשר הכפול של BH4 וגם ליון הברזל. | יון הברזל בא בין החנקן בחומצות אמיניות היסטידין His285 ו- His290 לבין חמצן בחומצה אמינית Glu330. מולקולת החמצן נקשרת לקשר הכפול של BH4 וגם ליון הברזל. | ||
| - | מצב המעבר של הסובסטראט נראה כך:(5) | + | מצב המעבר של הסובסטראט נראה כך:(5, 7) |
[[Image:Pah_meh.png ]]</div> | [[Image:Pah_meh.png ]]</div> | ||
| Line 79: | Line 79: | ||
4. http://en.wikipedia.org/wiki/Tyrosine | 4. http://en.wikipedia.org/wiki/Tyrosine | ||
| - | 5. Teigen K. The Reaction Mechanism of Phenylalanine Hydroxylase - A Question of Coordination. Pteridines Vol. 16, 2005, pp. 27 - 34 | + | 5. Teigen K. The Reaction Mechanism of Phenylalanine Hydroxylase - A Question of Coordination. Pteridines Vol. 16, 2005, pp. 27 - 34. |
| + | |||
| + | 6. Andersen O.A., Flatmark T., Hough E. Crystal Structure of the Ternary Complex of the Catalytic Domain of Human Phenylalanine Hydroxylase with Tetrahydrobiopterin and 3-(2-Thienyl)-L-alanine, and its Implications for the Mechanism of Catalysis and Substrate Activation. J. Mol. Biol. (2002) 320, 1095–1108. | ||
| + | |||
| + | 7. Fitzpatrick P. F. Tetrahydropterin-Dependent Amino Acid Hydroxylases. Annu. Rev. Biochem. 1999. 68:355–381. | ||
| + | |||
| + | 8. Shi Z., Sellers J., Moult J. Protein stability and in vivo concentration of missense mutations in phenylalanine hydroxylase. Proteins 2012; 80:61–70. | ||
Revision as of 09:51, 28 February 2013
Contents |
PAH פנילאלנין הידרוקסילאז
מבנה החלבון
| |||||||||||
מבנה המונומר של פנילאלנין הידרוקסילאז
גרף רמצ'נדראן של מונומר
גרף רמצ'נדראן של דימר
המבנה הרביעוני של פנילאלנין הידרוקסילאז
פעילות האנזים פנילאלנין הידרוקסילאז וחשיבותו
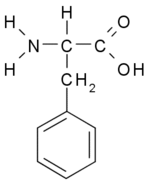
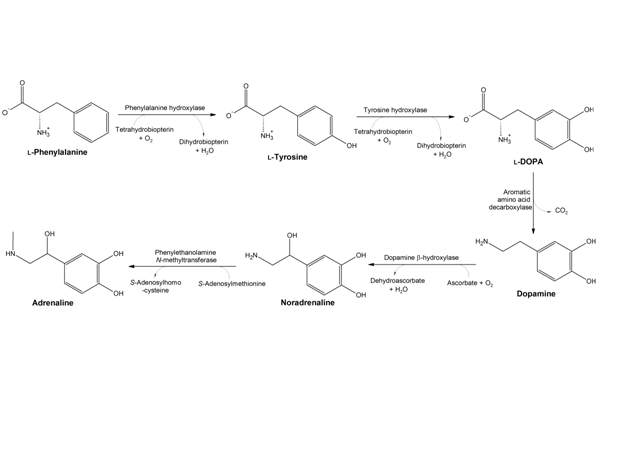
פנילאלנין היא חומצה אמינית חיונית שמשתתפת בתהליך יצירת נוירוטרנסמיטרים האחראיים לפעילות תקינה של המוח. ניתן לקבל חומצה אמינית זו ממזון כמו מוצרי בשר, חלב וקטניות. כמו כן היא נמצאת במזונות עמילניים (כמו תפ"א, פסטב, תירס) . פנילאלנין מופיע בחלב אם של יונקים ומשמש כחומר משכך כאבים ונוגד דיכאון.
מבנה הכימי של חומצה אמינית:שימושים נוספים בפנילאלנין: משתמשים בפנילאלנין כתוסף מזון לבעלי חיים, לספורטאים, לייצור אספרטאם (ממתיק מלאכותי למשקאות מוגזים, גומי לעיסה ומזון אחר).(1)
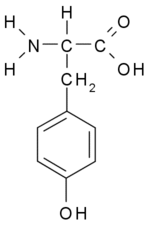
טירוזין הוא חומצה אמינית המשמשת לתהליכים שונים בגוף ובמיוחד ידועה כבסיס להורמון תירוקסין המופרש מבלוטת התריס ואחראי על חילוף החומרים בגוף. (3) חומצה אמינית זו מתקבלת ע"י פירוק של חומצה אמינית פנילאלנין ע"י אנזים פניל אלאנין הידרוקסילאז ולכן אינה חיונית (אין צורך בצריכת מזון כלשהו בכדי לספק אותה). חומצה אמינית טירוזין נמצאת במזון כמו סויה, עוף ותרנגול הודו, דגים, בוטנים, שקדים, אבוקדו, בננות, חלב ומוצריו (בעיקר גבינה צהובה, יוגורט וגבינת קוטג'), שעועית, פול, גרעיני דלעת, גרגירי שומשום וכן תוספי תזונה שונים.(3)
היסטידין His 285 וטריפטופן Trp326 יוצרות אינטראקציות π-π בין טבעות הבנזניות שלהן ואלה של הסובסטראט (פנילאלנין), וארגינין Arg270 , סרין Ser349 ותראונין Thr278 מגיבות עם הקבוצות הטעונות של הסובסטראט. האינטראקציות גורמות לכך שפנילאלנין מקבל כיווניות מתתאימה להמשך התגובה. יון הברזל בא בין החנקן בחומצות אמיניות היסטידין His285 ו- His290 לבין חמצן בחומצה אמינית Glu330. מולקולת החמצן נקשרת לקשר הכפול של BH4 וגם ליון הברזל. מצב המעבר של הסובסטראט נראה כך:(5, 7)
בדיקת גוטרי היא בדיקת דם שנערכת בקרב יילודים. בבדיקה נבדקת רמת החומצה האמינית פנילאלנין בדם, וכבר בדם של יילוד בן יומיים ניתן לזהות רמות גבוהות של פנילאלנין בדם, המעידות על חסר באנזים פנילאלנין הידרוקסילאז
מוטציות הפוגעות בפעילות האנזים פנילאלנין הידרוקסילאז
1. http://he.wikipedia.org/wiki/%D7%A4%D7%A0%D7%99%D7%9C%D7%90%D7%9C%D7%A0%D7%99%D7%9F
2. http://ru.wikipedia.org/wiki/%D0%A4%D0%B5%D0%BD%D0%B8%D0%BB%D0%B0%D0%BB%D0%B0%D0%BD%D0%B8%D0%BD
3. http://he.wikipedia.org/wiki/%D7%98%D7%99%D7%A8%D7%95%D7%96%D7%99%D7%9F
4. http://en.wikipedia.org/wiki/Tyrosine
5. Teigen K. The Reaction Mechanism of Phenylalanine Hydroxylase - A Question of Coordination. Pteridines Vol. 16, 2005, pp. 27 - 34.
6. Andersen O.A., Flatmark T., Hough E. Crystal Structure of the Ternary Complex of the Catalytic Domain of Human Phenylalanine Hydroxylase with Tetrahydrobiopterin and 3-(2-Thienyl)-L-alanine, and its Implications for the Mechanism of Catalysis and Substrate Activation. J. Mol. Biol. (2002) 320, 1095–1108.
7. Fitzpatrick P. F. Tetrahydropterin-Dependent Amino Acid Hydroxylases. Annu. Rev. Biochem. 1999. 68:355–381.
8. Shi Z., Sellers J., Moult J. Protein stability and in vivo concentration of missense mutations in phenylalanine hydroxylase. Proteins 2012; 80:61–70.