Aricept Complexed with Acetylcholinesterase (Vietnamese)
From Proteopedia
(Difference between revisions)
| Line 11: | Line 11: | ||
Kết quả | Kết quả | ||
| - | + | Cấu trúc X-ray của phức hợp E2020-''Tc''AChE chỉ ra rằng E2020 có định hướng riệng biệt dọc theo rãnh xúc tác của Enzim, kéo dài từ vùng điện âm ở đáy của rãnh xúc tác (Tryptophan84) đến vùng điện âm rìa ở đỉnh của rãnh xúc tác, thông qua sự tương tác chổng nhau của vòng aromatic với amino acid có vòng aromatic bảo toàn. E2020 không tương tác trực tiếp với bộ ba xúc tác hoặc hốc oxyanion, mà thương tác gián tiếp thông qua dung môi. | |
==Results== | ==Results== | ||
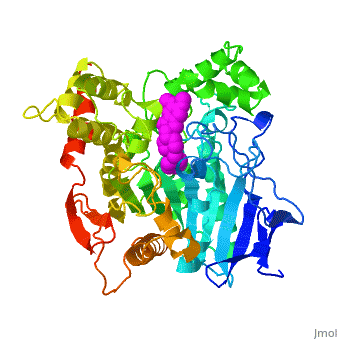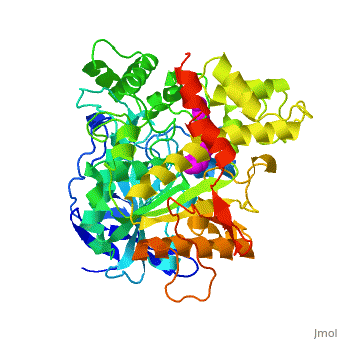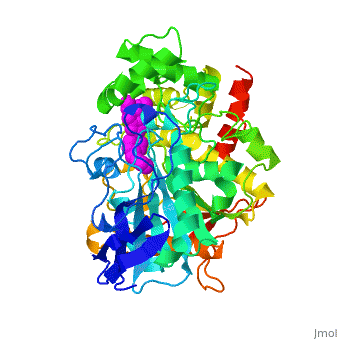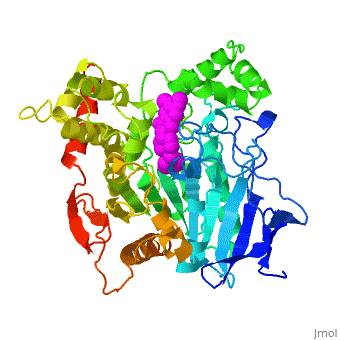
The X-ray structure of the E2020-''Tc''AChE complex shows that E2020 has a <scene name='1eve/E2020_close_up_with_84_279/13'>unique orientation</scene> along the active-site gorge, extending from the anionic subsite (<scene name='1eve/E2020_close_up_with_84lbld/7'>W84</scene>) of the active site, at the bottom, to the peripheral anionic site (<scene name='1eve/E2020_close_up_with_84_279lbld/5'>near W279</scene>), at the top, via aromatic stacking interactions with conserved aromatic acid residues. E2020 does not, however, interact directly with either the catalytic triad or the 'oxyanion hole' but only <scene name='1eve/E20_interactionshown/8'>indirectly via solvent molecules</scene>. | The X-ray structure of the E2020-''Tc''AChE complex shows that E2020 has a <scene name='1eve/E2020_close_up_with_84_279/13'>unique orientation</scene> along the active-site gorge, extending from the anionic subsite (<scene name='1eve/E2020_close_up_with_84lbld/7'>W84</scene>) of the active site, at the bottom, to the peripheral anionic site (<scene name='1eve/E2020_close_up_with_84_279lbld/5'>near W279</scene>), at the top, via aromatic stacking interactions with conserved aromatic acid residues. E2020 does not, however, interact directly with either the catalytic triad or the 'oxyanion hole' but only <scene name='1eve/E20_interactionshown/8'>indirectly via solvent molecules</scene>. | ||
| + | Kết luận | ||
| + | Cấu trúc X-ray cho thấy E 2020 tận dụng một số tín năng quan | ||
==Conclusions== | ==Conclusions== | ||
The X-ray structure shows, a posteriori, that the design of E2020 took advantage of several important features of the active-site gorge of AChE, to produce a drug with both high affinity for AChE and a high degree of selectivity for AChE versus butyrylcholinesterase (BChE). It also delineates voids within the gorge that are not occupied by E2020 and could provide sites for potential modification of E2020 to produce drugs with improved pharmacological profiles. | The X-ray structure shows, a posteriori, that the design of E2020 took advantage of several important features of the active-site gorge of AChE, to produce a drug with both high affinity for AChE and a high degree of selectivity for AChE versus butyrylcholinesterase (BChE). It also delineates voids within the gorge that are not occupied by E2020 and could provide sites for potential modification of E2020 to produce drugs with improved pharmacological profiles. | ||
Revision as of 14:02, 25 April 2017
| |||||||||||
Reference
Structure of acetylcholinesterase complexed with E2020 (Aricept): implications for the design of new anti-Alzheimer drugs., Kryger G, Silman I, Sussman JL, Structure. 1999 Mar 15;7(3):297-307. PMID:10368299
See 1eve (Chinese), 1eve (French), 1eve (Arabic), 1eve (Russian), 1eve (Spanish), & 1eve (Turkish).