This old version of Proteopedia is provided for student assignments while the new version is undergoing repairs. Content and edits done in this old version of Proteopedia after March 1, 2026 will eventually be lost when it is retired in about June of 2026.
Apply for new accounts at the new Proteopedia. Your logins will work in both the old and new versions.
Sandbox pah
From Proteopedia
| Line 64: | Line 64: | ||
===<div dir='rtl'> מוטציות הפוגעות בפעילות האנזים פנילאלנין הידרוקסילאז </div>=== | ===<div dir='rtl'> מוטציות הפוגעות בפעילות האנזים פנילאלנין הידרוקסילאז </div>=== | ||
| - | <div dir='rtl'><u> החלפת פרולין Pro281 בלויצין - </u> פרולין מכתיבה פיתול בשרשרת הפוליפפטידית. פרולין Pro281 ממוקמת בסמך ליון הברזל ומכתיבה מבנה מרחבי מסויים. החלפתה בלויצין משנה את המבנה המרחבי של האתר הפעיל, פוגמת בפעילות האנזים וגורמת למחלה (9). </div> | + | <div dir='rtl'><u> החלפת פרולין Pro281 בלויצין - </u>פרולין מכתיבה פיתול בשרשרת הפוליפפטידית. פרולין Pro281 ממוקמת בסמך ליון הברזל ומכתיבה מבנה מרחבי מסויים. החלפתה בלויצין משנה את המבנה המרחבי של האתר הפעיל, פוגמת בפעילות האנזים וגורמת למחלה (9). </div> |
<div dir='rtl'><u> החלפת ארגינין Arg408 בטריפטופאן -</u> ארגינין Arg408 מייצבת קשרי מימן בין הדומיין הקטאליטי לבין הדומיין שאחראי על אוליגומריזציה. ארגינין גם מאפשרת עמדה מדוייקת של 4 מונומרים זה ביחס לזה, לשם שחלוף דומיינים ויצירת טטרמר. הטריפטופאן מפריעה ליצירת קשרי מימן ומשבשת את יצירת הטטרמר וגורמת בכך לסימפטומים חמורים של PKU פנילקטונוריה (9). </div> | <div dir='rtl'><u> החלפת ארגינין Arg408 בטריפטופאן -</u> ארגינין Arg408 מייצבת קשרי מימן בין הדומיין הקטאליטי לבין הדומיין שאחראי על אוליגומריזציה. ארגינין גם מאפשרת עמדה מדוייקת של 4 מונומרים זה ביחס לזה, לשם שחלוף דומיינים ויצירת טטרמר. הטריפטופאן מפריעה ליצירת קשרי מימן ומשבשת את יצירת הטטרמר וגורמת בכך לסימפטומים חמורים של PKU פנילקטונוריה (9). </div> | ||
<div dir='rtl'><u> החלפת חומצה גלוטאמית Glu76 באלנין ובגליצין -</u> גלוטמית Glu76 יוצרת קשרי מימן עם היסטידין His208 ועם אספרגין Asn73 במונונמר אחר ובכך יוצרת דימר. החלפתה בארגינין ובגליצין שהן חומצות אמיניות הידרופוביות מונעת יצירת קשרי מימן ופוגעת ביצירת הדימר (9). </div> | <div dir='rtl'><u> החלפת חומצה גלוטאמית Glu76 באלנין ובגליצין -</u> גלוטמית Glu76 יוצרת קשרי מימן עם היסטידין His208 ועם אספרגין Asn73 במונונמר אחר ובכך יוצרת דימר. החלפתה בארגינין ובגליצין שהן חומצות אמיניות הידרופוביות מונעת יצירת קשרי מימן ופוגעת ביצירת הדימר (9). </div> | ||
| Line 84: | Line 84: | ||
4. http://en.wikipedia.org/wiki/Tyrosine | 4. http://en.wikipedia.org/wiki/Tyrosine | ||
| - | 5. Teigen K. The Reaction Mechanism of Phenylalanine Hydroxylase - A Question of Coordination. Pteridines Vol. 16, 2005, pp. 27 - 34 | + | 5. Teigen K. The Reaction Mechanism of Phenylalanine Hydroxylase - A Question of Coordination. Pteridines Vol. 16, 2005, pp. 27 - 34. |
| + | |||
| + | 6. Andersen O.A., Flatmark T., Hough E. Crystal Structure of the Ternary Complex of the Catalytic Domain of Human Phenylalanine Hydroxylase with Tetrahydrobiopterin and 3-(2-Thienyl)-L-alanine, and its Implications for the Mechanism of Catalysis and Substrate Activation. J. Mol. Biol. (2002) 320, 1095–1108. | ||
| + | |||
| + | 7. Fitzpatrick P. F. Tetrahydropterin-Dependent Amino Acid Hydroxylases. Annu. Rev. Biochem. 1999. 68:355–381 | ||
| + | |||
| + | 8. Shi Z., Sellers J., Moult J. Protein stability and in vivo concentration of missense mutations in phenylalanine hydroxylase. Proteins 2012; 80:61–70. | ||
| + | |||
9. web pages of course in Advanced Biochemistry and Molecular Biology BCMB8010 at the University of Georgia</div> | 9. web pages of course in Advanced Biochemistry and Molecular Biology BCMB8010 at the University of Georgia</div> | ||
Current revision
Contents |
PAH פנילאלנין הידרוקסילאז
מבנה החלבון
| |||||||||||
מבנה המונומר של פנילאלנין הידרוקסילאז
גרף רמצ'נדראן של מונומר
גרף רמצ'נדראן של דימר
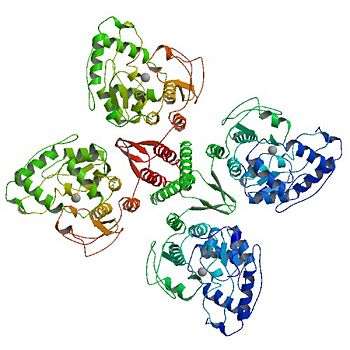
המבנה הרביעוני של פנילאלנין הידרוקסילאז
פעילות האנזים פנילאלנין הידרוקסילאז וחשיבותו
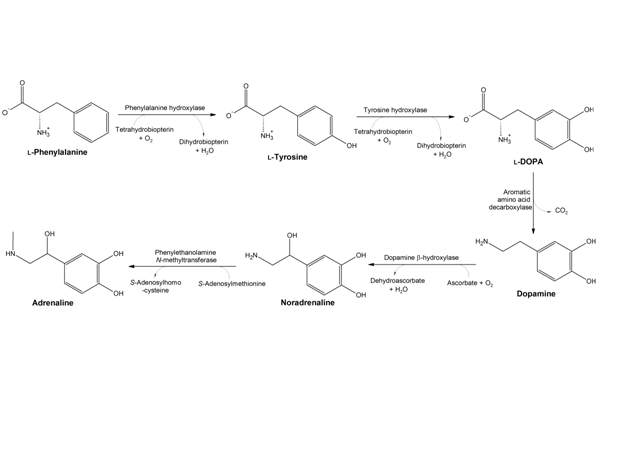
פנילאלנין היא חומצה אמינית חיונית שמשתתפת בתהליך יצירת נוירוטרנסמיטרים האחראיים לפעילות תקינה של המוח. ניתן לקבל חומצה אמינית זו ממזון כמו מוצרי בשר, חלב וקטניות. כמו כן היא נמצאת במזונות עמילניים (כמו תפו"א, פסטה, תירס) . פנילאלנין מצויה בחלב אם של יונקים ומשמשת כחומר משכך כאבים ונוגד דיכאון.
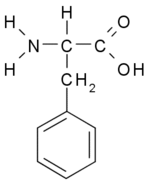
המבנה הכימי של פנילאלנין:שימושים נוספים בפנילאלנין: תוסף מזון לבעלי חיים, לספורטאים ולייצור אספרטיים (ממתיק מלאכותי למשקאות מוגזים, גומי לעיסה ומזון אחר).(1)
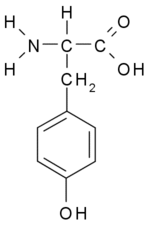
טירוזין היא חומצה אמינית המשמשת לתהליכים שונים בגוף ובמיוחד ידועה כבסיס להורמון תירוקסין המופרש מבלוטת התריס ואחראי על חילוף החומרים בגוף (3). כמו כן משמשת טירוזין בתהליכי הסינתיזה של מוליכים עצביים מסוג קטכולאמינים - דופאמין, אדרנלין, נוראדרנלין, וגם כמקור למלנין (פיגמנט של העור)(4) . טירוזין נוצרת בגוף מן החומצה האמינית פנילאלנין. כאמור, האנזים פניל אלאנין הידרוקסילאז משמש זרז בתגובה. אי לכך, טירוזין אינה חומצה אמינית חיונית (אין צורך בצריכת מזון כלשהו בכדי לספק אותה). יחד עם זאת, ניתן למצוא טירוזין במזונות כמו סויה, עוף, דגים, בוטנים, שקדים, אבוקדו, בננות, חלב ומוצריו (בעיקר גבינה צהובה, יוגורט וגבינת קוטג'), שעועית, פול, גרעיני דלעת, גרגירי שומשום וכן בתוספי תזונה שונים.(3)
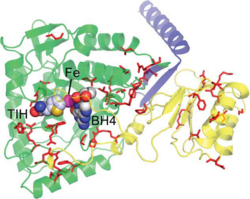
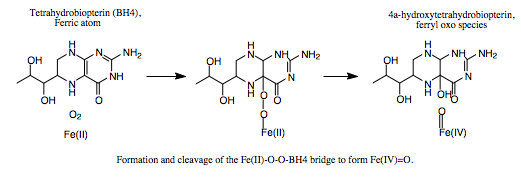
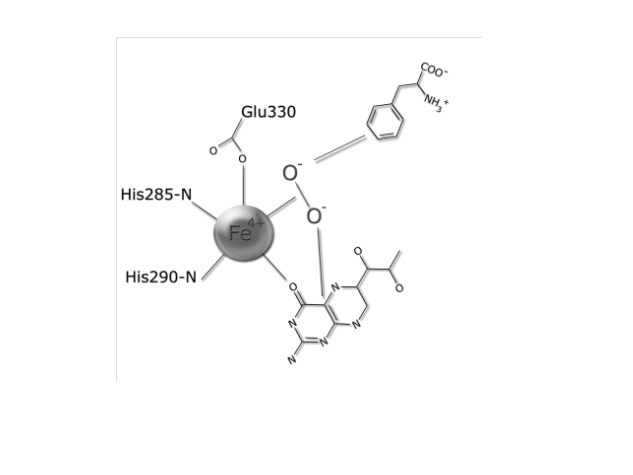
היסטידין His 285 וטריפטופן Trp326 יוצרות אינטראקציות π-π בין הטבעות הבנזניות שלהן ואלה של הסובסטראט (פנילאלנין), וארגינין Arg270 , סרין Ser349 ותראונין Thr278 מגיבות עם הקבוצות הטעונות של הסובסטראט. האינטראקציות גורמות לכך שפנילאלנין מקבל כיווניות מתאימה להמשך התגובה. יון הברזל נקשר בין החנקן בחומצות אמיניות היסטידין His285 ו- His290 לבין החמצן בחומצה האמינית Glu330. מולקולת החמצן נקשרת לקשר הכפול של BH4 וגם ליון הברזל. מצב המעבר של אתר הקישור בין האנזים לסובסטרט מתואר להלן:(5)
בדיקת גוטרי היא בדיקת דם שנערכת בקרב יילודים. בבדיקה נבדקת רמת החומצה האמינית פנילאלנין בדם, וכבר בדם של יילוד בן יומיים ניתן לזהות רמות גבוהות של פנילאלנין בדם, המעידות על חסר באנזים פנילאלנין הידרוקסילאז (9).
מוטציות הפוגעות בפעילות האנזים פנילאלנין הידרוקסילאז
לסיכום
ביבליוגרפיה
1. http://he.wikipedia.org/wiki/%D7%A4%D7%A0%D7%99%D7%9C%D7%90%D7%9C%D7%A0%D7%99%D7%9F
2. http://ru.wikipedia.org/wiki/%D0%A4%D0%B5%D0%BD%D0%B8%D0%BB%D0%B0%D0%BB%D0%B0%D0%BD%D0%B8%D0%BD
3. http://he.wikipedia.org/wiki/%D7%98%D7%99%D7%A8%D7%95%D7%96%D7%99%D7%9F
4. http://en.wikipedia.org/wiki/Tyrosine
5. Teigen K. The Reaction Mechanism of Phenylalanine Hydroxylase - A Question of Coordination. Pteridines Vol. 16, 2005, pp. 27 - 34.
6. Andersen O.A., Flatmark T., Hough E. Crystal Structure of the Ternary Complex of the Catalytic Domain of Human Phenylalanine Hydroxylase with Tetrahydrobiopterin and 3-(2-Thienyl)-L-alanine, and its Implications for the Mechanism of Catalysis and Substrate Activation. J. Mol. Biol. (2002) 320, 1095–1108.
7. Fitzpatrick P. F. Tetrahydropterin-Dependent Amino Acid Hydroxylases. Annu. Rev. Biochem. 1999. 68:355–381
8. Shi Z., Sellers J., Moult J. Protein stability and in vivo concentration of missense mutations in phenylalanine hydroxylase. Proteins 2012; 80:61–70.
9. web pages of course in Advanced Biochemistry and Molecular Biology BCMB8010 at the University of Georgia