Aricept Complexed with Acetylcholinesterase (Vietnamese)
From Proteopedia
(Difference between revisions)
| Line 3: | Line 3: | ||
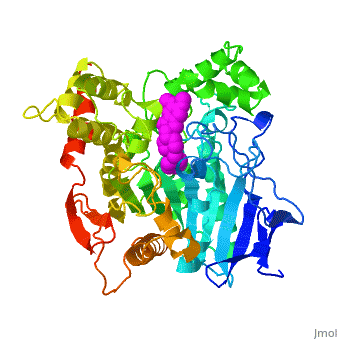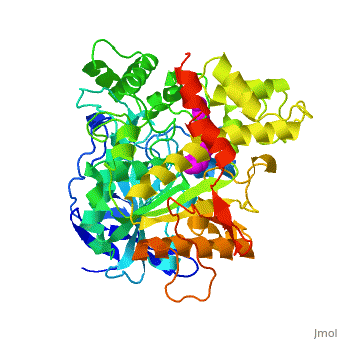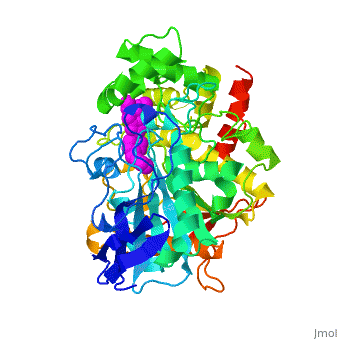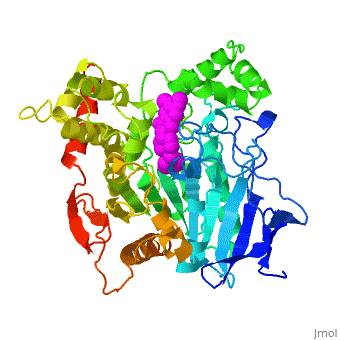
'''3D structure of anti-Alzheimer's drug, Aricept, complexed with acetylcholinesterase''' | '''3D structure of anti-Alzheimer's drug, Aricept, complexed with acetylcholinesterase''' | ||
(see also [[AChE bivalent inhibitors (Part II)]]) | (see also [[AChE bivalent inhibitors (Part II)]]) | ||
| - | ==Background== | ||
| - | + | Giới thiệu | |
| + | Vài chất ức chế Enzim Cholinesterase đang được sử dụng trong điều trị bệnh Alzheimer hoặc đang trong thử nghiệm lâm sàng. E2020, tên gọi trên thị trường là Aricept, là một thành viên trong một nhóm chất ức chế Enzim N-benzylpiperidine-based [[acetylcholinesterase]] (AChE) đã được nghiện cứu phát triển, tổng hợp và kiểm duyệt bởi công ty Eisai ở Nhật. Những chất ức chế này được thiết kế đựa trên nền tảng của nghiên cứu QSAR, và sau đó được làm sáng tỏ bằng cấu trúc 3D của AChE thuộc loài Torpedo californica (''Tc''AChE). Chất ức chế này tác dụng rất đáng kể trên cuộc thử nghiệm ở động vật kém khả năng cholinergic và có ái lực nM đối với AChE ở lươn điện và chuột. | ||
| - | Several cholinesterase inhibitors are either being utilized for symptomatic treatment of Alzheimer's disease or are in advanced clinical trials. '''E2020''', marketed as '''Aricept''', is a member of a large family of N-benzylpiperidine-based [[acetylcholinesterase]] (AChE) inhibitors, developed, synthesized and evaluated by the Eisai Company in Japan. These inhibitors were designed on the basis of QSAR studies prior to elucidation of the 3D structure of ''Torpedo californica'' AChE (''Tc''AChE) ([[1ea5]]). It significantly enhances performance in animal models of cholinergic hypofunction and has a high affinity for AChE, binding to both electric eel and mouse AChE in the nanomolar range. | ||
{{Clear}} | {{Clear}} | ||
Kết quả | Kết quả | ||
| - | cáu trúc X-ray của phức hợp E2020-AChE chỉ ra rằng E2020 có định hướng riệng biệt dọc theo rãnh xúc tác của Enzim, kéo dài từ vùng điện âm ở đáy của rãnh xúc tác (Tryptophan84) đến vùng điện âm rìa ở đỉnh của rãnh xúc tác, thông qua sự tương tác chổng nhau của vòng | + | cáu trúc X-ray của phức hợp E2020-AChE chỉ ra rằng E2020 có định hướng riệng biệt dọc theo rãnh xúc tác của Enzim, kéo dài từ vùng điện âm ở đáy của rãnh xúc tác (Tryptophan84) đến vùng điện âm rìa ở đỉnh của rãnh xúc tác, thông qua sự tương tác chổng nhau của vòng |
| + | |||
==Results== | ==Results== | ||
The X-ray structure of the E2020-''Tc''AChE complex shows that E2020 has a <scene name='1eve/E2020_close_up_with_84_279/13'>unique orientation</scene> along the active-site gorge, extending from the anionic subsite (<scene name='1eve/E2020_close_up_with_84lbld/7'>W84</scene>) of the active site, at the bottom, to the peripheral anionic site (<scene name='1eve/E2020_close_up_with_84_279lbld/5'>near W279</scene>), at the top, via aromatic stacking interactions with conserved aromatic acid residues. E2020 does not, however, interact directly with either the catalytic triad or the 'oxyanion hole' but only <scene name='1eve/E20_interactionshown/8'>indirectly via solvent molecules</scene>. | The X-ray structure of the E2020-''Tc''AChE complex shows that E2020 has a <scene name='1eve/E2020_close_up_with_84_279/13'>unique orientation</scene> along the active-site gorge, extending from the anionic subsite (<scene name='1eve/E2020_close_up_with_84lbld/7'>W84</scene>) of the active site, at the bottom, to the peripheral anionic site (<scene name='1eve/E2020_close_up_with_84_279lbld/5'>near W279</scene>), at the top, via aromatic stacking interactions with conserved aromatic acid residues. E2020 does not, however, interact directly with either the catalytic triad or the 'oxyanion hole' but only <scene name='1eve/E20_interactionshown/8'>indirectly via solvent molecules</scene>. | ||
Revision as of 13:37, 25 April 2017
| |||||||||||
Reference
Structure of acetylcholinesterase complexed with E2020 (Aricept): implications for the design of new anti-Alzheimer drugs., Kryger G, Silman I, Sussman JL, Structure. 1999 Mar 15;7(3):297-307. PMID:10368299
See 1eve (Chinese), 1eve (French), 1eve (Arabic), 1eve (Russian), 1eve (Spanish), & 1eve (Turkish).