User:Carolina Castro Hernández/TFG/Parte4
From Proteopedia
<< Página Anterior | Índice | Página Siguiente >>
9. Receptor de gp120:CD4
El receptor CD4 es una proteína que consta de cuatro dominios (dos variables y dos constantes) de tipo inmunoglobulina, que se extienden desde la superficie celular externa, unidos a una cola corta citoplásmica intracelular.
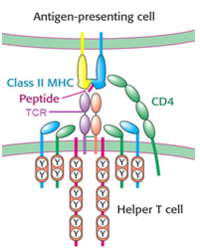
Su función consiste en la comunicación con una célula presentadora de antígeno por medio de moléculas MHC-II, y la amplificación de la señal generada por el receptor de células T (TCR, en inglés) a través de una enzima Lck que desencadena una cascada de señalización (Fig.2).
En lo que respecta a la intervención de CD4 como receptor de gp120 del VIH, la unión receptor-ligando induce grandes cambios en la conformación de Env, es decir, una reorganización del trímero desde una posición cerrada (estado previo a la fusión) a la forma abierta. Los principales cambios ocurren en los residuos M150 y M161 en V1/V2, así como en regiones de la lámina puente y en F316 de V3 que forman el sitio de unión al correceptor (Guttman et al., 2014).
En el momento inicial, los bucles V1/V2 de gp120 están ocluyendo parcialmente el sitio de unión al receptor. Al aproximarse CD4 a la gp120 para el reconocimiento, se produce un cambio conformacional en gp120 que supone la exposición de una pequeña cavidad que es el sitio de unión de CD4 (Kwong et al., 1998). Debido a sus dimensiones los anticuerpos no pueden acceder, además de que las zonas de alrededor están glicosiladas y, en consecuencia, impiden también el reconocimiento por los anticuerpos.
Un residuo de fenilalanina en posición 43 (Phe43) de CD4 es el residuo clave para la interacción con la gp120 puesto que es el único capaz de penetrar y unirse a ese sitio de unión tan estrecho. Sin embargo, el estudio de Saphire et al. (2001), demostró que un residuo de triptófano (Trp100) del anticuerpo b12 también puede ocupar la cavidad Phe43 e inducir la conformación típica de la unión de CD4 a gp120.
|
Después de la , queda accesible en esta última el sitio de unión al correceptor. Está formado por un núcleo hidrofóbico rodeado de cargas positivas (Kwong et al., 2000). La mayor parte de la estructura de este sitio de unión está conservada aunque, dependiendo del tropismo viral, cada correceptor requiere de unos residuos exclusivos que proporcionan la especificidad (Cormier y Dragic, 2002).
Finalmente, todas estas alteraciones estructurales desencadenan más cambios que conducen a la fusión de la membrana viral con la celular mediada por gp41 (Kwong et al., 1998).
Teniendo en cuenta lo anterior, la cavidad Phe43 es crucial para la entrada del VIH a la célula. Por ello, se han llevado a cabo muchos estudios para identificar los aminoácidos implicados y la superficie de esa unión en la interacción entre gp120 y CD4.
Los resultados de Grupping et al. (2012) muestran que más de un 50% de la superficie de interacción está formada por los residuos 365-371 y 425-430 de gp120, así como los aminoácidos que rodean (Trp112, Val255, Thr257, Glu370, Phe382, Tyr384, Trp427, Met475). Aunque estos residuos contribuyan poco a la interacción directa con CD4, sin duda pueden tener un efecto en la unión de los anticuerpos en ese mismo sitio (Kwong et al., 1998).
Los residuos que forman esta cavidad están muy conservados y son esenciales para el proceso de entrada viral. Por lo tanto constituyen objetivos particularmente interesantes para el desarrollo de vacunas y diseño de fármacos. Se están investigando una serie de inhibidores muy prometedores para esta cavidad Phe43, los compuestos miméticos de CD4 (miniCD4), tales como M48 y M48U1. Constan de 27 aminoácidos y son muy estables a altas temperaturas y pH ácido, e incluso a la degradación proteolítica (Martin et al., 2003). Estos miniCD4 inducen cambios conformacionales en la glicoproteína gp120 de la envoltura viral y, como resultado, son inhibidores con una gran capacidad de neutralización. No obstante, un problema derivado de su uso es la adquisición de resistencia hacia esas moléculas aunque ésta podría reducirse combinándolos con otros antirretrovirales (Grupping et al., 2012).
10. Correceptores de gp120: CCR5 y CXCR4
Una vez Env está acoplado a CD4, la subunidad gp120 se activa para unirse al correceptor (CCR5 y/o CXCR4). Al hacerlo, las subunidades de la gp41 cambian su conformación lo que permite la fusión de las membranas viral y celular. Por otra parte, se han encontrado variantes poco frecuentes del VIH que seleccionadas in vitro pueden utilizar CXCR4 en ausencia de CD4 (Edwards et al., 2001), lo que sugiere que CD4 no es absolutamente necesario para la entrada viral.
En el contexto del sistema inmune, la inflamación y el desarrollo, los receptores de quimiocinas son reguladores críticos de la migración celular. Estos receptores son miembros de la familia de receptores acoplados a proteínas G (GPCR, en inglés). Todos los miembros de esta familia se caracterizan por sus siete dominios transmembrana con estructura de α-hélice (I a VII), que rodean un poro central, conectados por tres bucles extracelulares (ECL1-3, extracellular loop, en inglés) y tres bucles intracelulares (ICL1-3, intracellular loop, en inglés), que transducen la señal a través de proteínas G heterotriméricas tras la unión del ligando correspondiente (Oppermann, 2004). Aparte de estos dominios, se componen de un segmento N-terminal extracelular que, junto con el ECL-2, es esencial en el apoyo a la entrada del VIH, y una cola citoplásmica C-terminal (Dragic, 2001).
Los ligandos de los GPCR, las quimiocinas, son pequeñas proteínas que reclutan células inmunes además de mediar la vigilancia del sistema. Se clasifican dependiendo del número de residuos cisteína y de su estructura: C, CC, CXC y CX3C (Barmania y Pepper, 2013). Adicionalmente, se designan con “R” aquellas moléculas que sean un receptor (Murphy et al., 2000).
Se han identificado in vitro más de 14 receptores diferentes como posibles correceptores para VIH y VIS por su capacidad de facilitar la infección de células CD4+ (Clapham y McKnight, 2001). A pesar de la alta homología de las estructuras de estos receptores, como por ejemplo entre CCR5 y CCR2 que comparten un 75% de secuencia (Combadiere et al., 1996), unen distintos ligandos y median procesos diferentes. Normalmente, la célula internaliza los complejos ligando-receptor después de la unión. Los ligandos naturales para CCR5 son: MIP-1α, MIP-1β (proteína inflamatoria de macrófagos, en inglés) y RANTES (regula la activación de células T expresadas y secretadas) (Combadiere et al., 1996).
|
10.1 CCR5
El contiene 352 aminoácidos (40,6 kDa) y se expresa en macrófagos principalmente, células dendríticas y células T de memoria (Rottman et al., 1997). Otra característica de este GPCR son los enlaces disulfuro entre dos residuos de cisteína en el segundo y tercer bucle extracelular (Wu et al., 2010): Cys101 con Cys178 de ECL-2, y Cys20 en el extremo N-terminal con Cys269 (Tan et al., 2013). El dominio N-terminal de CCR5 posee algunas modificaciones postraduccionales en su estructura que confieren cargas negativas adicionales en esta región debido a que algunos residuos de tirosina han sido modificados con sulfato, y así contribuyen a la capacidad de CCR5 para interactuar con sus ligandos naturales o con la gp120 (Farzan et al., 1999). Además, los residuos de carga negativa en la posición 11 y 18 también participan en esta interacción entre el CCR5 y residuos conservados de la región C4/V3 de la gp120 (Cormier et al., 2001).
10.2 CXCR4
El correceptor para la cepa X4 del VIH es , que se activa exclusivamente por su ligando SDF-1. La estructura principal de CXCR4 es similar a la de CCR5, y se compone de 34 residuos N-terminales, ECL-1 (residuos 100-104) que enlaza las hélices II y III, ECL-2 (residuos 174-192) uniendo las hélices IV y V, y ECL-3 (residuos 267-273) conectando las hélices VI y VII (Wu et al., 2010).
10.3 Interacción de los correceptores con gp120
Se ha dilucidado una analogía estructural entre el lazo V3 de gp120 y una región de longitud similar en estas quimiocinas, es decir, los ligandos de los correceptores. Esto sugiere que las estructuras V3 de las cepas virales X4 y R5 evolucionaron para imitar las quimiocinas pertinentes, SDF-1 y RANTES, pudiendo así interactuar con sus respectivos receptores (Sharon et al., 2003).
El lazo V3 de la gp120 es una estructura de aproximadamente 35 residuos, frecuentemente glicosilada, muy variable, y unida por puentes disulfuro. Se ha demostrado que la secuencia de V3 es un determinante principal de la especificidad del receptor de quimiocinas, directa o indirectamente, que puede determinar qué correceptor (CCR5, CXCR4, o ambos) se requiere para activar la fusión del complejo Env, y por lo tanto que las células puedan ser infectadas por el virus del SIDA (Hartley et al., 2005).
Además, también se ha demostrado que la región V1/V2 es capaz de mediar el uso de receptores de quimiocinas adicionales (Ross y Cullen, 1998), lo que sugiere que las interacciones cooperativas entre V1/V2 y V3 estén implicadas en el reconocimiento del receptor de quimiocinas (Labranche et al., 1999).
10.4 Inhibidores de los correceptores
|
Teniendo en cuenta el papel del correceptor CCR5, se ha diseñado un fármaco antirretroviral que es antagonista de CCR5, denominado (comercializado como Selzentry en Estados Unidos, y Celsentri, en Europa). El uso de esta pequeña molécula fue aprobado en 2007 indicado para individuos infectados con tropismo R5. No obstante, se han observado variantes resistentes que también podrían ser debidas al uso del correceptor CXCR4 (Westby et al., 2006), de manera que también se ha diseñado un pequeño inhibidor llamado para las cepas X4.
En la estructura del complejo , se demuestra que Maraviroc se encuentra profundamente situado en el bolsillo del correceptor definido por residuos de hélices I, II, III, V, VI y VII: dos residuos de nitrógeno protonados unidos por un puente salino con Glu283, y un enlace de hidrógeno con Tyr251. La cadena carbonada situada entre ellos parece ser crítica para la actividad anti-VIH de Maraviroc, lo que sugiere una posibilidad de estabilizar la conformación inactiva de CCR5 (Tan et al., 2013). Por el contrario, la estructura de es menos abierta que el bolsillo de CCR5 debido a algunas sustituciones de residuos.
El bloqueo del complejo receptor-ligando por interacción de Maraviroc impide la internalización tanto de CCR5 como de sus ligandos naturales, lo que resulta en un aumento de dicho receptor en la superficie celular, así como también un aumento de ligandos de CCR5 en circulación. Estos ligandos también podrían unirse a otros receptores de quimiocinas, incluyendo CCR3 y CCR4 en las células T, y CCR1 en monocitos y neutrófilos (Hunt et al., 2013).
Los estudios de Hunt et al. (2013) muestran que el aumento de dosis de Maraviroc, además de sus efectos antirretrovirales, no alteró la tasa de recuperación de las células T CD4+. Sin embargo, aumentó los recuentos de células T+ en sangre periférica. También aumentaron los niveles plasmáticos de MIP-1β y tendió a aumentar la activación de los monocitos y los niveles de neutrófilos. En resumen, el aumento del inhibidor significaría un aumento de la activación de células T, monocitos y neutrófilos al haber ligandos libres en sangre periférica.
11. Mutación CCR5Δ32
El gen CCR5 se compone de tres exones, dos intrones y dos promotores. Se localiza dentro de un grupo de genes que codifican otros receptores de quimiocinas, entre ellos CCR1, CCR2, CCR3, XCR1 y CCBP2 en el cromosoma 3p21 (Samson et al, 1996; Liu et al., 1996).
Algunas personas infectadas por VIH experimentan una mutación en el gen del correceptor CCR5, denominada mutación CCR5Δ32, que confiere un efecto protector a las células frente a la infección por el virus dando como resultado una progresión más lenta de la enfermedad en individuos heterocigotos (Ioannidis et al., 2001). Esta protección se debe a la supresión de la expresión de CCR5 en la superficie celular. De esto se deduce que los individuos homocigotos serían CCR5 negativos (Clapham y McKnight, 2001), es decir, la entrada del VIH estaría inhibida por la ausencia del correceptor. No obstante, el hecho de inducir artificialmente el fenotipo negativo para CCR5 podría conllevar consecuencias que aún se desconocen (Barmania y Pepper, 2013).
Hasta la fecha, no se han esclarecido los orígenes de la mutación CCR5Δ32 aunque repeticiones en tándem en la región codificante del gen podrían producir recombinación homóloga desigual resultando así en el alelo mutante. También se sugiere que la subpoblación de homocigotos adquirieron esta mutación hace miles de años, lo cual les habría permitido evolucionar y adaptarse a la falta del correceptor desviando sus funciones hacia otras estructuras alternativas (Barmania y Pepper, 2013).
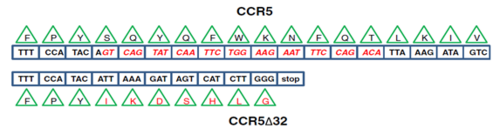
Esta mutación se descubrió en 1996 (Samson et al., 1996). Liu et al. (1996) reveló una deleción de 32 pares de bases (nucleótidos de 794 a 825) a través de un análisis genético del marco de lectura abierto (ORF, en inglés) del gen. Sin embargo, también implica la adición de siete nuevos aminoácidos en posición 174 y un codón stop en la posición 182 (Fig. 3). Se obtiene como resultado que el alelo mutante contiene 215 aminoácidos, en comparación con el tipo silvestre que contiene 352 aminoácidos (Barmania y Pepper, 2013).
Agrawal et al. (2004) demostraron en su investigación in vitro que la proteína mutante reduce la expresión de tipo silvestre CCR5 y CXCR4 en la superficie celular mediante dimerización. Esto confiere una inhibición de amplio espectro para todas las cepas.
En principio, los individuos homocigotos para la mutación Δ32 con tropismo R5 están sanos y no presentan ningún problema aparente (Barmania y Pepper, 2013). Los individuos homocigotos con expresión de la proteína mutante en las células CD4+, parecen tener también una menor expresión de CXCR4 y con ello, una disminución de la susceptibilidad de las células a la infección por cepas X4. Por esta razón, la proteína mutante Δ32 es de gran importancia para la resistencia a la infección por VIH. Otro punto a tener en cuenta es que la proteína mutante está presente en individuos heterocigotos y, consecuentemente, pueden ser propensos a perder más de la mitad de los receptores CCR5 en la superficie de las células que lo presentan, aunque el desarrollo del SIDA es significativamente más lento, lo que demuestra la importancia de este receptor en la patogénesis del VIH (Clapham y McKnight, 2001).
En cuanto al receptor CXCR4, todavía no se han encontrado polimorfismos significativos, probablemente porque CXCR4 es un requisito esencial en el desarrollo como lo demuestra que el fenotipo “knockout” en ratones sea letal (Clapham y McKnight, 2001).
Aparte del efecto protector de esta mutación contra el virus del SIDA, el alelo Δ32 también se ha asociado con enfermedades coronarias e infarto de miocardio (Szalai et al, 2001; González et al, 2001). El alelo mutante se asoció con niveles más bajos en plasma de triglicéridos y de HDL, ambos beneficiosos en la disminución del riesgo de enfermedad cardiovascular (Hyde et al., 2010).
Desde el descubrimiento de la mutación Δ32 y su efecto protector, los investigadores tienen como objetivo el gen de CCR5 a nivel de ADN, transcripción y expresión de proteínas, de manera que diseñando pequeños ARN interferentes (siRNA, en inglés) modularían la transcripción de las proteínas virales conduciéndolas a su reducción y posterior degradación (Novina et al., 2002; Liang et al, 2010).
El estudio realizado por Anderson et al. (2009) utilizó un vector lentiviral para transducir células humanas CCR5+. Los resultados mostraron el éxito contra la diana específica y una reducción del 93% en la expresión de CCR5 confiriendo así una resistencia al VIH.